Gli anticorpi IgG4 indotti da vaccinazioni ripetute possono generare tolleranza immunitaria alla proteina spike SARS-CoV-2
Mdpi.com. Un nuovo studio pubblicato di recente ha rilevato che più vaccini COVID-19 una persona ha ricevuto, più il suo sistema immunitario diventa indebolito. I ricercatori hanno esposto all’interno dello studio il meccanismo di come ciò accade, che ha a che fare con il picco nella produzione di anticorpi IgG4 all’interno del corpo del destinatario del vaccino.
Un nuovo corpo di ricerca ha recentemente scoperto che questi anticorpi IgG4 non sono benigni, ma possono portare a una pletora di problemi per il corpo umano, tra cui cancro, disfunzione d’organo, insufficienza d’organo e persino la morte.
Il nome tecnico per questo è IgG4-Related Disease.
Gli anticorpi IgG4 indotti da vaccinazioni ripetute possono generare tolleranza immunitaria alla proteina spike SARS-CoV-2
presso
Vladimir N. Uversky 1,*,
Elrashdy M. Redwan 2,3,
William Makis 4 e
1
Dipartimento di Medicina Molecolare e USF Health Byrd Alzheimer’s Research Institute, Morsani College of Medicine, University of South Florida, Tampa, FL 33612, USA
2
Dipartimento di Scienze Biologiche, Facoltà di Scienze, King Abdulaziz University, P.O. Box 80203, Jeddah 21589, Arabia Saudita
3
Therapeutic and Protective Proteins Laboratory, Protein Research Department, Genetic Engineering and Biotechnology Research Institute, City for Scientific Research and Technology Applications, New Borg EL-Arab, Alexandria 21934, Egitto
4
Cross Cancer Institute, Alberta Health Services, 11560 University Avenue, Edmonton, AB T6G 1Z2, Canada
5
Autlan Regional Hospital, Health Secretariat, Autlan 48900, Jalisco, Messico
6
Laboratorio di Biologia, Autlan Regional Preparatory School, Università di Guadalajara, Autlan 48900, Jalisco, Messico
*
Ricevuto: 2 aprile 2023 / Data revisione: 12 maggio 2023 / Accettato: 15 maggio 2023 / Pubblicato: 17 Maggio 2023
Astratto
Meno di un anno dopo l’emergere globale del coronavirus SARS-CoV-2, è stata introdotta sul mercato una nuova piattaforma vaccinale basata sulla tecnologia mRNA. A livello globale, sono state somministrate circa 13,38 miliardi di dosi di vaccino COVID-19 di diverse piattaforme. Ad oggi, al 72,3% della popolazione totale è stato iniettato almeno una volta un vaccino COVID-19. Poiché l’immunità fornita da questi vaccini diminuisce rapidamente, la loro capacità di prevenire l’ospedalizzazione e la malattia grave in individui con comorbidità è stata recentemente messa in discussione e prove crescenti hanno dimostrato che, come con molti altri vaccini, non producono immunità sterilizzante, consentendo alle persone di soffrire di frequenti reinfezioni. Inoltre, recenti indagini hanno trovato livelli anormalmente elevati di IgG4 nelle persone a cui sono state somministrate due o più iniezioni dei vaccini mRNA. I vaccini contro l’HIV, la malaria e la pertosse sono stati segnalati anche per indurre la sintesi di IgG4 superiore al normale. Nel complesso, ci sono tre fattori critici che determinano il passaggio di classe agli anticorpi IgG4: eccessiva concentrazione di antigene, vaccinazione ripetuta e tipo di vaccino utilizzato. È stato suggerito che un aumento dei livelli di IgG4 potrebbe avere un ruolo protettivo prevenendo l’iper-attivazione immunitaria, simile a quella che si verifica durante l’immunoterapia allergenico-specifica di successo inibendo gli effetti indotti da IgE. Tuttavia, prove emergenti suggeriscono che l’aumento riportato dei livelli di IgG4 rilevato dopo ripetute vaccinazioni con i vaccini mRNA potrebbe non essere un meccanismo protettivo; piuttosto, costituisce un meccanismo di tolleranza immunitaria alla proteina spike che potrebbe promuovere l’infezione e la replicazione incontrastate da SARS-CoV2 sopprimendo le risposte antivirali naturali. L’aumento della sintesi di IgG4 dovuto alla ripetuta vaccinazione dell’mRNA con alte concentrazioni di antigene può anche causare malattie autoimmuni e promuovere la crescita del cancro e la miocardite autoimmune in individui sensibili.
2. Caratteristiche dell’insolito anticorpo IgG4
Diverse classi e sottoclassi di immunoglobuline che costituiscono l’arsenale immunitario degli anticorpi, tra cui IgA, IgE, IgM e IgG, sono essenzialmente identificate dalla struttura della loro regione costante della catena pesante. Le immunoglobuline umane G (IgG) sono suddivise in quattro sottocategorie in base all’immunogenicità delle loro catene pesanti (IgGl, IgG2, IgG3 e IgG4) [32,33,34]. Le sottoclassi di immunoglobuline differiscono nella loro regolazione fisiologica di base, localizzazione in tutto l’organismo e impegno con i recettori sulle cellule effettrici del sistema immunitario [35]. IgG4, la sottoclasse meno diffusa, si trova nel siero a valori medi di 0,35-0,51 mg / ml [36], mentre i livelli di IgG1, la sottoclasse più diffusa, oscillano tra 5 e 12 mg / ml [37]. A causa delle sue caratteristiche biologiche insolite e della carenza di funzioni effettrici, come la capacità di distruggere le cellule infette attraverso l’attivazione del sistema del complemento o l’uso di anticorpi, IgG4 è stato indicato come un anticorpo insolito non aderendo alla teoria accettata della struttura e della funzione degli anticorpi [38,39].
Il meccanismo alla base della reazione che coinvolge la sostituzione di una metà di un anticorpo con un’altra, noto anche come scambio del braccio Fab e specifico per gli anticorpi IgG4, è stato chiarito negli ultimi vent’anni [40]. Le catene pesanti possono dissociarsi e poi ricombinarsi arbitrariamente a causa della maggiore propensione alla riduzione dei legami naturali del disolfuro articolare IgG4, risultando in un gruppo eterogeneo di molecole IgG4 con coppie casuali a catena pesante e leggera (Figura 1) [40].
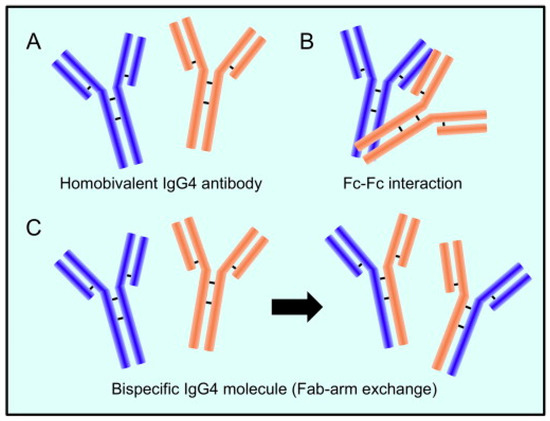
Figura 1. L’anticorpo IgG4 ha una struttura distintiva. (A). Due catene pesanti e due catene leggere costituiscono l’anticorpo IgG4. (B). Il frammento Fc di una molecola di IgG4 può reagire con il frammento Fc di un’altra. (C). Quando vengono scambiate mezze molecole (chiamato interscambio Fab-braccio), IgG4 combina due specificità distinte in un’unica molecola (anticorpo bispecifico). Riprodotto da [41]. Questo è un articolo ad accesso libero distribuito sotto i termini della licenza Creative Commons CC-BY, che consente l’uso, la distribuzione e la riproduzione senza restrizioni su qualsiasi mezzo, a condizione che l’opera originale sia adeguatamente citata.
La maggior parte delle molecole di IgG4 avrà due distinti bracci Fab a causa dello scambio di semi-anticorpi, rendendoli “bi-specifici” e operativamente univalenti per un particolare antigene. Di conseguenza, lontano dalle altre sottoclassi IgG, gli anticorpi IgG4 in circolazione non sono in grado di formare complessi immunologici con antigeni. Gli anticorpi IgG4 hanno un limitato potenziale teorico di attivazione immunologica a causa della loro debole affinità per i recettori C1q e Fc. La produzione di immunocomplessi stimola il sistema del complemento e l’azione delle cellule effettrici immunitarie. Inoltre, gli anticorpi IgG4 possono essere in grado di bloccare gli effetti infiammatori degli anticorpi IgG1 o IgE rimuovendo il legame di quelli con specificità comparabili. La caratteristica antinfiammatoria può offrire informazioni su un altro fatto importante che gli anticorpi IgG4 si formano tipicamente dopo un contatto prolungato con un allergene, riducendo così il livello di infiammazione cronica [28].
La designazione “malattia sistemica correlata a IgG4” si riferisce a diverse manifestazioni cliniche che in precedenza si pensava fossero malattie completamente distinte. L’elenco degli organi collegati a questa malattia è in continua espansione. Indipendentemente dall’organo coinvolto, le biopsie tissutali mostrano significative somiglianze istologiche. Tuttavia, ci sono anche lievi variazioni tra gli organi. I risultati patologici caratteristici includono fibrosi diffusa, numerose plasmacellule IgG4-positive e infiltrati linfo-plasmacitoidi dispersi [42].
2.1. IgG4: un anticorpo protettivo o patogeno?
La reputazione di IgG4 come “anticorpo bloccante” deriva dalla sua diminuita capacità di suscitare reazioni effettrici del sistema immunitario [43,44]. Ciò implica che ci sarà solo una risposta immunitaria minima quando IgG4 interagisce con le molecole [45]. Una risposta IgG4 può essere patogena o protettiva, a seconda della situazione. Ad esempio, IgG4 è spesso indicato come un anticorpo bloccante di salvaguardia perché può sopprimere o arrestare l’infiammazione competendo con IgE infiammatorie per il legame dell’antigene in caso di allergie e infezioni da elminti e parassiti filariali. Al contrario, IgG4 può portare a gravi malattie in diverse malattie autoimmuni [46] e cancro [47,48]. La sua bifunzionalità sarà esaminata a fondo nelle prossime sottosezioni.
2.1.1. Ruolo protettivo delle IgG4 nell’immunoterapia allergologica
La mancanza di azione effettrice delle IgG4 e i fenomeni di interscambio di semianticorpi creano complicate considerazioni sul fatto che questi anticorpi siano dannosi o se agiscano come reazione controregolatrice a una malattia immunologica duratura [40]. Alte concentrazioni di IgG4 antigene-specifiche sono collegate a risultati soddisfacenti nell’immunoterapia allergenico-specifica inibendo gli effetti mediati dall’immunoglobulina E (IgE) (Figura 2), secondo studi pubblicati [49,50]. In vari aspetti, lo sviluppo di una tolleranza agli allergeni è un passo essenziale nello sviluppo di un forte sistema immunitario. Quindi, per sviluppare una desensibilizzazione prolungata contro gli allergeni, vengono utilizzati percorsi che coinvolgono risposte modificate delle cellule T e B della memoria allergenico-specifiche che portano alla tolleranza immunologica [50,51,52].
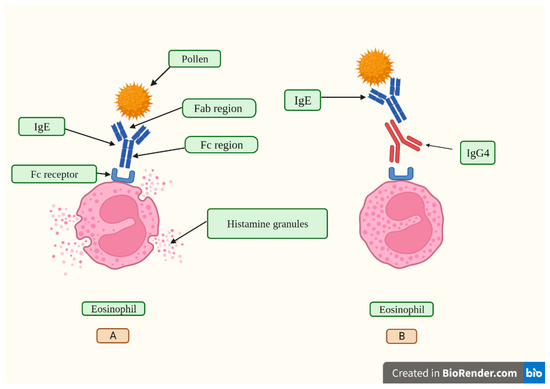
Figura 2. In (A), un granello di polline viene riconosciuto attraverso la regione legante l’antigene del frammento (Fab) di un anticorpo IgE. Successivamente, le IgE si attaccano al suo recettore, chiamato Fc epsilon RI (FcεRI), situato sui leucociti eosinofili e induce il rilascio di istamina dai granuli citoplasmatici. L’istamina è un peptide vasoattivo che causa sintomi come prurito, starnuti, naso che cola, prurito alla gola, occhi e orecchie e problemi di respirazione durante una reazione allergica indotta dal polline. In (B), la regione cristalizzabile (Fc) del frammento di un anticorpo IgG4 si lega alla regione Fc di un anticorpo IgE, inibendo il suo legame al recettore FcεRI e bloccando così gli effetti IgE-mediati. Creato con Biorender.
2.1.2. Malattia correlata alle IgG4 e sua patogenesi
La malattia correlata alle IgG4 (IgG4-RD) è una malattia fibro-infiammatoria che prende il nome dalla presenza di numerose plasmacellule IgG4+ nei tessuti danneggiati e da alte concentrazioni sieriche di IgG4 nella maggior parte, ma non in tutti, i casi [53]. Diversi autoanticorpi sono stati trovati nel siero di individui con IgG4-RD, secondo rapporti precedenti [54,55,56,57,58,59]. Inoltre, è noto che la terapia steroidea è in genere abbastanza efficace nel trattamento dei pazienti con IgG4-RD. Queste caratteristiche suggeriscono che la malattia è di origine autoimmune. Rituximab, un anticorpo anti-CD20, ha prodotto notevoli risposte cliniche nei pazienti con IgG4-RD in recenti indagini, accompagnate da una considerevole diminuzione delle cellule B e dei plasmablasti [60].
Questi risultati implicano che l’aumento delle concentrazioni di IgG e / o IgG4 nei soggetti IgG4-RD può svolgere ruoli dannosi [61]. A causa dei suoi particolari tratti biologici, come la capacità di scambiare bracci Fab [45], l’incapacità di legare il complemento e la debole affinità per i recettori Fc [62], IgG4 è considerata un’immunoglobulina antinfiammatoria. Gli anticorpi IgG4, tuttavia, funzionano come autoanticorpi dannosi per i tessuti in alcuni disturbi, come si è visto nella miastenia grave [63], nella glomerulonefrite membranosa idiopatica [64] e nel pemfigo vulgaris (PV) [65].
IgG4-RD include una “vasta varietà di malattie, precedentemente diagnosticate come malattia di Mikulicz (MD) [66], pancreatite autoimmune (AIP) [67], tiroidite di Riedel [68], polmonite interstiziale [69,70], nefrite interstiziale [71,72], prostatite, linfoadenopatia [73,74], fibrosi retroperitoneale (RPF) [75,76] e aneurisma dell’aorta infiammatoria [77]”. Svolge anche un ruolo significativo nella patogenesi di almeno 13 malattie autoimmuni. È stato dimostrato che gli animali da laboratorio passivamente infusi con IgG o IgG4 totali umane sviluppano segni in 5 di questi 13 disturbi, dimostrando la patogenicità di questo anticorpo. L’autoimmunità indotta da IgG4 è suggerita dalla scoperta che la maggior parte degli autoanticorpi antigene-specifici sono della classe IgG4 e che le loro concentrazioni sono correlate con la gravità della malattia per gli otto disturbi rimanenti [46]. Ad esempio, la miastenia grave (MG), che è caratterizzata dalla produzione di anticorpi che si attaccano alla chinasi muscolo-specifica (MuSK), si distingue per rigidità muscolare sporadica con coinvolgimento significativo dei muscoli assiali e bulbari. Ad un certo stadio durante la malattia, una parte significativa dei pazienti richiede supporto respiratorio [78,79].
Dopo l’identificazione degli anticorpi MuSK nel 2001, è diventato rapidamente evidente che la loro predominanza della sottoclasse IgG4 e la correlazione tra titoli e gravità della malattia erano risultati chiave [80,81,82]. L’IgG4 ad alta purezza dei pazienti con MuSK MG è stato in grado di attaccarsi alle connessioni neuromuscolari nel muscolo del topo, ma non IgG1-3 dagli stessi pazienti o di controllare IgG4. L’iniezione con questo anticorpo ha causato un fenotipo miastenico in animali immunocompromessi [83,84,85]. Questi test hanno dimostrato in modo conclusivo la patogenicità delle IgG4 [86].
Ruolo di IgG4 nel cancro
Gli inibitori del checkpoint immunitario, spesso noti come agenti immunoterapici del cancro, impediscono alle proteine del checkpoint di legarsi con i loro polipeptidi associati, consentendo ai linfociti T citotossici CD8 + (CTL) di attaccare le cellule tumorali. Gli agenti bloccanti il checkpoint immunitario (ICB) includono anticorpi monoclonali anti-CTLA-4 (antigene citotossico dei linfociti T 4) e anti-PD-1 (proteina di morte cellulare programmata 1) [87,88]. L’ICB ha dimostrato efficacia terapeutica in una vasta gamma di tipi di cancro, compresi i pazienti oncologici in stadio avanzato [89,90,91]. Purtroppo, solo il 15-30% dei pazienti oncologici che hanno ricevuto un trattamento beneficiano dell’efficacia terapeutica dell’ICB [92]. Ancora più importante, nuovi rapporti mostrano che alcuni pazienti oncologici che ricevono un trattamento con anticorpi monoclonali anti-PD-1 hanno una rapida progressione della malattia (nota anche come malattia iperprogressiva (HPD) invece della remissione del cancro [93,94,95]. In particolare, l’anticorpo PD-1 appartiene alla famiglia IgG4. Inoltre, i tumori, come il melanoma maligno [48], il colangiocarcinoma extraepatico [96] e il cancro del pancreas [97], sono stati collegati a infiltrati plasmatici di cellule B che sono IgG4-positivi. Il contributo delle IgG4 al cancro è poco conosciuto, ma uno studio innovativo ha aggiunto nuove importanti conoscenze. Karagiannis et al. [48] hanno studiato il melanoma maligno e hanno scoperto che l’espressione di IL-4 e IL-10 era elevata e che le IgG4 tumore-specifiche erano generate localmente nei tessuti tumorali. È comune pensare a IL-10 come una citochina antinfiammatoria; Tuttavia, questo è vero solo in basse quantità, poiché a concentrazioni maggiori, mostra effetti pro-infiammatori [98,99,100].
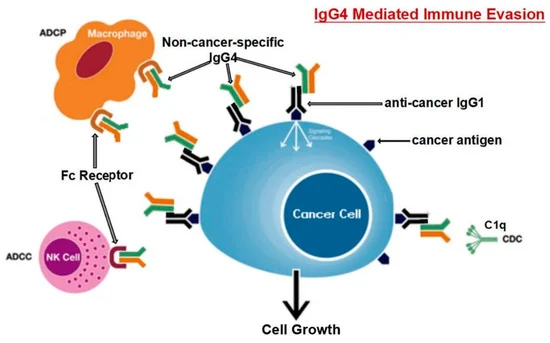
Karagiannis et al. [48] hanno anche scoperto che, a differenza delle IgG1 specifiche per il cancro, le IgG4 specifiche per il cancro non sono riuscite ad attivare due processi immunologici che impiegano anticorpi per identificare e distruggere le cellule tumorali. Inoltre, l’anticorpo IgG1 è stato in grado di sopprimere la progressione del cancro in un modello in vivo, mentre IgG4 non è riuscito a farlo. Gli anticorpi IgG4 non possono attaccare direttamente le cellule tumorali e possono interferire con il processo di morte delle cellule tumorali mediato dagli anticorpi IgG1. L’inibizione del legame e dell’attivazione di IgG1 da parte di Fc RI è il meccanismo alla base di questa attività ostruente. Tali risultati indicano una caratteristica precedentemente non studiata della fuga immunitaria indotta dal tumore: la sintesi di IgG4 indotta dai tumori limita le attività delle cellule immunitarie effettrici contro i tumori [48]. Un’altra opera [101] giunse alla stessa conclusione; cioè, l’anticorpo IgG4 è importante e necessario per l’evasione immunitaria del cancro. In una coorte di individui con cancro esofageo, le cellule B che producono alte concentrazioni di IgG4 sono state marcatamente aumentate nelle cellule maligne e anche in campioni di siero dai pazienti. Più IgG4 sembra essere collegato a una crescita più aggressiva del cancro, ed entrambi erano fortemente associati a una maggiore malignità del cancro e a una prognosi infausta. È stato scoperto che le IgG4 possono competere con le IgG1 (come mostrato in Figura 3) nel legarsi ai recettori Fc presenti in alcune cellule immunitarie in vitro. Questa competizione si traduce nell’inibizione delle risposte immunitarie tipiche contro le cellule tumorali, come la citotossicità cellulare e del complemento e la fagocitosi cellulare, che sono mediate dagli anticorpi IgG1.
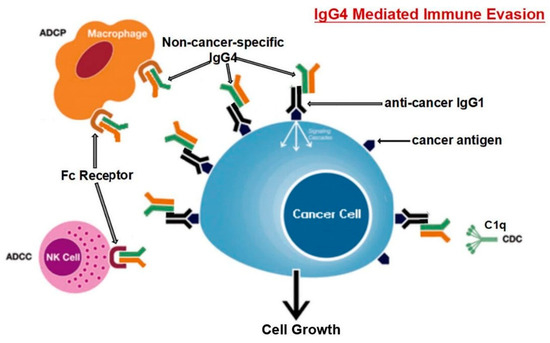
Figura 3. Il percorso suggerito per l’evasione immunitaria sviluppato dalle cellule tumorali attraverso IgG4 prodotte dai linfociti B è rappresentato schematicamente. L’esposizione prolungata agli antigeni del cancro fa sì che le cellule B cambino la loro classe e generino IgG4. Con la sua caratteristica di legame Fc-Fc, tale IgG4 potenziata può interagire con le IgG legate al cancro e con i recettori Fc sulle cellule effettrici immunitarie. L’aumento delle IgG4 nel microambiente tumorale promuove un efficiente meccanismo di evasione immunitaria per il cancro grazie alle sue speciali proprietà strutturali e biologiche. Gli acronimi ADCC, ADCP, CDC e NK stanno rispettivamente per citotossicità cellulo-mediata anticorpo-dipendente, fagocitosi cellulare anticorpo-dipendente, citotossicità complemento-dipendente e cellule natural killer. Riprodotto da [101]. Questo è un articolo ad accesso libero distribuito sotto la licenza Creative Commons Attribution Non-Commercial (CC BY-NC 4.0), che consente ad altri di distribuire, remixare, adattare, costruire su questo lavoro non commercialmente e concedere in licenza le loro opere derivate a termini diversi, a condizione che l’opera originale sia correttamente citata, venga dato un credito appropriato, che vengano indicate eventuali modifiche apportate e che l’uso non sia commerciale.
Livelli localmente elevati di IgG4 nel tessuto tumorale hanno ostacolato le risposte antitumorali mediate da anticorpi, aiutato il cancro a bloccare la risposta immunitaria locale e indirettamente aiutato nella progressione del cancro. Tre diversi modelli di topi immuno-potenti hanno supportato questa teoria. È stato scoperto che la somministrazione locale di IgG4 accelera notevolmente la crescita dei tumori del colon-retto e della mammella impiantati, nonché dei papillomi cutanei causati da agenti cancerogeni. I ricercatori hanno anche esaminato l’anticorpo IgG4 Nivolumab, che viene utilizzato nell’immunoterapia del cancro, e hanno scoperto che accelera drasticamente lo sviluppo del cancro nei topi rispetto ai gruppi tampone fosfato (PBS) e trattati con IgG1 [101].
I ricercatori hanno utilizzato modelli di topi immunologicamente competenti per valutare la loro ipotesi ed esplorare ulteriormente il meccanismo mediato da tali anticorpi. Un modello prevedeva l’iniezione di IgG4 non specifiche per il cancro nel sito di inoculazione sottocutanea per le cellule del cancro al seno. Rispetto ad altri gruppi di topi (iniettati con PBS o IgG1 senza IgG4), la proliferazione delle cellule tumorali di questo gruppo è stata drasticamente accelerata, generando una massa tumorale significativamente più grande di 21 giorni. Poiché IgG4 non ha alcuna influenza diretta sulla proliferazione delle cellule tumorali, questi risultati indicano inequivocabilmente che le cellule tumorali utilizzano l’anticorpo IgG4 per bloccare le risposte immunologiche locali e quindi consentire la crescita del cancro in vivo attraverso la fuga immunitaria. Questo potrebbe spiegare la sindrome iper-progressiva scoperta di recente che è occasionalmente legata al trattamento del cancro con inibitori PD-1 [101].
Il sistema immunitario può rilevare tumori che altrimenti potrebbero sfuggire alla sorveglianza immunitaria grazie agli anticorpi terapeutici inibitori del checkpoint immunitario che si attaccano al recettore della proteina di morte cellulare programmata 1 (PD-1). Tuttavia, gli anticorpi IgG4 possono anche causare una reazione autoimmune impedendo la capacità del sistema immunitario di essere soppresso dalle cellule T regolatorie [102]. Curiosamente, gli anticorpi anti-PD-1 sono di classe IgG4, sollevando la preoccupazione che questa terapia sia un’arma a doppio taglio. Ad esempio, i pazienti che usano inibitori del checkpoint immunitario da soli o in combinazione sono stati collegati a casi di miocardite acuta [103,104,105,106], a volte con conseguenze letali [107].
3. Il ruolo degli anticorpi IgG4 indotti da diversi vaccini
Un’ampia revisione della letteratura ha dimostrato che i vaccini mRNA non sono gli unici che inducono la produzione di anticorpi IgG4. Anche i vaccini contro l’HIV, la malaria e la pertosse hanno suscitato una tale risposta. Nel complesso, ci sono tre fattori critici che determinano il passaggio di classe agli anticorpi IgG4: eccessiva concentrazione di antigene, vaccinazione ripetuta e tipo di vaccino utilizzato.
3.1. Eccessiva concentrazione di antigene nei vaccini
Rispetto a BNT162b2, il vaccino mRNA-1273 aveva una maggiore capacità di indurre una risposta prolungata alle IgG4. La quantità e la durata della proteina spike prodotta sono presumibilmente influenzate dalle maggiori concentrazioni di mRNA nel vaccino mRNA-1273 (100 μg) rispetto al vaccino BNT162b2 (30 μg). Curiosamente, tra i vaccini mRNA, il vaccino mRNA-1273 ha generato un aumento delle concentrazioni sieriche di IgG1 anti-S4 in individui non infetti da COVID-19 con ripercussioni precedentemente sconosciute sulla difesa dei patogeni. Fino al giorno 270, le persone non infette che hanno ricevuto il vaccino a base di adenovirus non hanno mostrato questa risposta IgG4 di lunga durata [31].
Il problema associato ai vaccini progettati per essere iniettati con una bassa concentrazione di antigene è una possibile assenza di risposta immunologica, e tradizionalmente c’è stata una forte connessione con la scuola di pensiero “più è meglio” che persiste, specialmente per l’ampia gamma di malattie infettive per le quali non esistono predittori immunitari affidabili di protezione indotta da vaccino (virus dell’immunodeficienza umana (HIV), tubercolosi (TB), virus dell’epatite C (HCV), ecc.) [108]. Una grande quantità (concentrazione della dose) o l’immunizzazione ripetuta con lo stesso antigene (vaccino) tende a indurre una tolleranza specifica delle cellule T (CD4 periferico) e successivamente inibire le risposte immunitarie [108,109]. Tuttavia, un’alta dose di antigene nell’immunizzazione primaria è stata raccomandata per le infezioni litiche, che è necessaria per la cooperazione sia umorale che cellulare, mentre una bassa dose di antigene è raccomandata per aumentare [110,111]. Una tecnica di escalation della dose è tipicamente impiegata nelle indagini cliniche di fase I sui vaccini per trovare la dose che produce la migliore risposta. Mentre questo ha senso per le malattie in cui non esiste un indicatore immunologico noto di protezione (quindi, una risposta robusta è probabilmente superiore a nessuna risposta), la dose massima che è stata tollerata e ha portato a una risposta positiva è stata spesso adottata per le successive indagini di fase II / III. Tuttavia, argomenti significativi contro questo approccio sono supportati da diversi risultati importanti [108]:
(1) Quando vengono iniettate quantità eccessive di antigene, può causare la morte cellulare, con conseguente perdita di un gruppo specifico di cellule T; Questo fenomeno è noto come delezione clonale.
(2) La tolleranza immunitaria può svilupparsi a seguito di una prolungata esposizione all’antigene. Le cellule T sono una parte essenziale del sistema immunitario che rileva e rimuove infezioni e altri oggetti estranei. Tuttavia, queste cellule T possono diventare desensibilizzate e perdere la loro capacità di reagire a esposizioni ripetute quando sono esposte a grandi concentrazioni di antigeni, come durante la vaccinazione ripetuta. La tolleranza immunitaria è una condizione che può anche provocare la persistenza di infezioni o l’emergere di malattie autoimmuni.
(3) Le cellule T possono subire un processo noto come “differenziazione terminale” quando i vaccini vengono somministrati in alte concentrazioni, a quel punto diventano altamente specializzati, perdendo la capacità di dividersi e proliferare. Il sistema immunitario si esaurisce di conseguenza e non è in grado di montare una difesa efficace contro le malattie successive. Questo è un problema poiché potrebbe minare i vantaggi protettivi delle vaccinazioni. Per bilanciare i vantaggi della protezione immunologica e i potenziali svantaggi dell’esaurimento immunitario, è fondamentale determinare attentamente la dose ideale di vaccini.
(4) Gli esiti avversi hanno maggiori probabilità di verificarsi nei gruppi che ricevono dosi maggiori.
(5) L’intensità della reazione tra un antigene e un recettore delle cellule T o un anticorpo è indicata come avidità. La risposta immunitaria è più efficace nell’identificare e rimuovere l’antigene bersaglio quando l’avidità è elevata. Alti dosaggi di antigene, tuttavia, possono provocare “esaurimento immunitario”, una condizione in cui le cellule del sistema immunitario diventano desensibilizzate e incapaci di montare una difesa di successo. L’avidità delle cellule T helper e degli anticorpi può diminuire di conseguenza, compromettendo la risposta immunologica all’antigene bersaglio. Per stabilire una risposta immunitaria forte ed efficace, è fondamentale valutare a fondo i dosaggi ideali dell’antigene utilizzati in immunoterapia [108].
Billeskov et al. [108] hanno fornito prove di casi in cui dosi più basse di antigene vaccinale hanno portato a risposte più positive da parte delle cellule T, sia per la qualità giudicata da diverse capacità effettori che per l’efficienza preventiva in esperimenti sia animali che umani, e hanno presentato argomenti per l’importanza di ridurre la dose di antigene per una protezione ottimale in alcuni modelli. Hanno anche incoraggiato gli esperti nella vaccinazione delle cellule T, in particolare, a ricordare che a volte, meno certamente è di più. In conclusione, esiste un legame tra la concentrazione della dose di antigene, l’esposizione ripetuta e l’induzione della produzione di IgG4? Oppure l’elevata concentrazione di IgG4 associata alla vaccinazione COVID-19 è dovuta alla predisposizione genetica? Poiché circa la metà dei vaccinati ha mostrato un sostanziale aumento della concentrazione di IgG4 dopo la seconda inoculazione di mRNA [30], è evidente che tale aumento non è causato da una predisposizione genetica. Inoltre, Moderna e Pfizer hanno utilizzato la stessa dose di antigene per le loro vaccinazioni primarie e di richiamo, il che contraddice il paradigma vaccinologico che mostra che una bassa dose di antigene è raccomandata per aumentare [110,111].
3.2. Vaccinazione ripetuta
3.2.1. Inoculazione ripetuta con vaccini COVID-19
I ricercatori hanno riferito che rapidamente dopo la somministrazione delle prime due dosi di vaccino mRNA, le sottoclassi pro-infiammatorie IgG1 e IgG3 hanno dominato la risposta IgG. Tuttavia, pochi mesi dopo il secondo vaccino Pfizer, gli anticorpi spike-specifici sono stati ulteriormente potenziati da una terza iniezione di mRNA e / o nuove infezioni causate dalla variante SARS-CoV-2 [30]. Di tutti gli anticorpi IgG generati contro la proteina spike, le IgG4 sono aumentate di più, costantemente dallo 0,04% immediatamente dopo la seconda vaccinazione al 19,27% in ritardo dopo la terza.
Un tale aumento dei livelli di IgG4 non è stato osservato in individui che hanno ricevuto lo stesso tipo o un diverso tipo di vaccino SARS-CoV-2 basato su vettori adenovirali, dimostrando che, in questo studio, il vaccino mRNA Pfizer era l’unico a causare questa risposta. Sorprendentemente, 7 mesi dopo la seconda inoculazione, i livelli di IgG4 nel siero di circa la metà dei vaccinati hanno superato il limite inferiore di rilevazione [30]. Per determinare se l’aumento della concentrazione di anticorpi IgG4 fosse esclusivo del programma di vaccinazione con mRNA omologo utilizzato, i ricercatori hanno studiato i sieri di un gruppo indipendente che ha valutato la capacità del sistema immunitario di reagire a programmi di immunizzazione simili e diversi, con il vaccino Pfizer e il vaccino adenovirale basato su vettori di AstraZeneca. Gli anticorpi anti-spike IgG4 sono stati nuovamente rilevati nel 50% dei sieri del gruppo BNT-BNT da cinque a sei mesi dopo la seconda vaccinazione, ma solo in uno dei 51 campioni di siero degli altri due gruppi vaccinali. Significativamente, dopo la terza immunizzazione di richiamo, è stato rilevato un aumento significativo dei livelli di anticorpi IgG4 praticamente in tutti i destinatari del vaccino [30].
A questo proposito, è stato recentemente dimostrato che seguendo lo schema di vaccinazione tradizionale, l’efficacia neutralizzante del siero nei topi contro le varianti Delta e Omicron del vaccino Pfizer COVID-19 è stata drasticamente ridotta dopo numerose dosi di richiamo [112]. Secondo quanto riferito, la stimolazione ripetuta dell’antigene ha causato l’esaurimento delle cellule T CD8 +. Questi booster hanno anche diminuito significativamente le risposte delle cellule T CD4 + e CD8 + e hanno migliorato la produzione della proteina di morte cellulare programmata 1 (PD-1) e del gene di attivazione dei linfociti 3 (LAG-3) in queste cellule T [112]. La vaccinazione prolungata ha ridotto il normale sviluppo del centro germinale e ostacolato la generazione di cellule B di memoria specifiche per RBD. Questa ricerca ha inoltre rivelato che l’immunizzazione prolungata del richiamo del vaccino RBD ha aumentato la concentrazione della citochina immunosoppressiva IL-10 e la proporzione di cellule Treg CD25 + Foxp3 + CD4 +. La capacità del vaccino convenzionale SARS-CoV-2 di fornire protezione immunologica può essere significativamente influenzata da un’eccessiva vaccinazione. Se ciò accade, i casi di COVID-19 di nuova diagnosi o le persone che hanno già contratto nuovamente il virus potrebbero avere un caso più grave della malattia. Questo concetto è stato proposto dopo aver visto la tolleranza delle risposte immunitarie umorali e cellulari alle dosi di immunizzazione prolungate di richiamo [112].
3.2.2. Inoculazione ripetuta con vaccini contro l’HIV
Uno studio di Chung et al. ha confrontato l’immunizzazione ripetuta con vaccini HIV simili in uno scenario di una sperimentazione di vaccinazione contro l’HIV. La protezione (31,2%) offerta da un vaccino (RV144) è stata descritta dagli autori come legata alla produzione di anticorpi IgG1 e IgG3, mentre la protezione dell’altro vaccino (VAX003) era trascurabile ed era associata alla produzione di anticorpi IgG4 dopo più cicli di vaccinazioni [113]. Poiché il vaccino VAX003 ha aumentato i livelli di IgG4, che sono stati storicamente collegati a una ridotta efficienza immunologica, i ricercatori volevano sapere se la produzione di IgG4 fosse semplicemente innescata in connessione con una risposta funzionale disordinata o se avesse dato un contributo significativo alla risposta organizzata in modo improprio. Quando gli anticorpi IgG4 sono stati eliminati da 16 campioni simili di entrambi gli studi, è stato osservato un aumento significativo dell’attività dell’ADCP e una tendenza verso un maggiore ADCC per i campioni VAX003 rispetto alle IgG di massa. Questi risultati mostrano che gli anticorpi IgG4 possono ridurre direttamente la funzione effettrice dell’anticorpo Fc, piuttosto che essere collegati solo alla generazione di una reazione ad hoc. Rispetto a VAX003, che ha prodotto anticorpi monofunzionali con quantità significative di IgG4 dopo sette vaccinazioni proteiche, RV144 ha prodotto anticorpi IgG3 altamente funzionali [113]. Pertanto, diverse vaccinazioni e protocolli vaccinali possono produrre risposte anticorpali persistenti, ma questi anticorpi IgG4 potrebbero non essere efficaci come le sottoclassi IgG1 e IgG3. Di conseguenza, il cambiamento della sottoclasse IgG da anticorpi completamente efficienti (IgG3) a IgG4 può costituire un ostacolo importante al successo del vaccino contro l’HIV [114].
Tali risultati sono simili a quelli recentemente riportati dopo ripetute vaccinazioni con mRNA; questo spostamento di classe di IgG4 è stato collegato a una ridotta capacità degli anticorpi spike-specifici di promuovere la deposizione del complemento e la fagocitosi cellulare anticorpo-dipendente [30]. Inoltre, gli anticorpi IgG3 indotti dal vaccino hanno migliorato le funzioni immunitarie come la citotossicità cellulo-mediata anticorpo-dipendente (ADCC) e la fagocitosi cellulare anticorpo-dipendente (ADCP), mentre gli anticorpi IgG4 indotti dal vaccino hanno bloccato questi processi [113]. Allo stesso modo, nello studio sull’HIV, la rimozione degli anticorpi IgG4 dal siero ha portato a significativi aumenti delle attività effettrici mediate da Fc, confermando un ruolo non protettivo per gli anticorpi IgG4. La produzione insolitamente elevata di IgG4 nel gruppo VAX003 potrebbe essere dovuta all’iniezione ripetuta di sette dosi di vaccino contenenti un’alta concentrazione di antigene in mancanza di un’appropriata stimolazione adiuvante, che potrebbe essere culminata in un’attivazione sproporzionata del recettore delle cellule B [113].
Da questi dati, è chiaro che la produzione di IgG4 nel gruppo VAX003 è stata associata a ripetuti aumenti (sette cicli di immunizzazione contro quattro cicli nel gruppo RV144), portando a una ridotta protezione dall’infezione da HIV; inoltre, questo passaggio di classe a IgG4 può promuovere infezioni rivoluzionarie a causa della compromissione delle risposte antivirali mediate da Fc [113]. Ciò supporta l’idea che un aumento delle sottoclassi di IgG4 potrebbe portare a una persistenza virale estesa in caso di infezione, considerando che l’azione effettrice mediata da Fc è essenziale per l’eliminazione virale [30].
3.2.3. Inoculazione ripetuta con il vaccino contro la malaria
La proteina di superficie 1 della merozoite (MSP-1), l’antigene legante gli eritrociti 175-kDa (EBA-175) e l’antigene della membrana apicale 1 (AMA-1) sono i tre obiettivi principali della risposta immunitaria naturale al parassita Plasmodium falciparum, che causa la malaria. Non era chiaro, quindi, se gli anticorpi contro questi antigeni agissero come agenti protettivi contro le malattie cliniche o servissero solo come marcatori di esposizione. In un gruppo di 302 bambini mozambicani di età compresa tra 5, 9, 12 e 24 mesi, sono stati utilizzati test altamente specifici per determinare le risposte anticorpali agli antigeni dello stadio ematico del Plasmodium falciparum come parte di uno studio randomizzato controllato con placebo tra il 2002 e il 2004. L’incidenza della malaria durante il periodo di follow-up è risultata essere correlata in modo diverso con le reazioni del sottotipo IgG all’antigene EBA-175 [115]. Poiché si ritiene che l’isotipo anticorpale evocato dagli antigeni di P. falciparum sia essenziale, l’effetto profilattico delle IgG è stato attribuito ai sottotipi neutralizzanti (IgG1 e IgG3) piuttosto che ai sottotipi non neutralizzanti (IgG2) (IgG2 e IgG4) [116,117,118,119,120]. La reattività delle IgG1 all’EBA-175 è stata costante nel primo anno di vita prima di aumentare l’anno successivo.
Mentre la reattività alle IgG4 è stata minima nel primo anno, ma significativamente aumentata all’età di 2 anni, la reattività delle IgG3 è rimasta moderata per tutto il periodo di studio. La reattività delle IgG3 è rimasta stabile per tutto il tempo, mentre le IgG4 sono state basse durante il primo anno, ma sono aumentate significativamente all’età di 2 anni. Lo studio si è concentrato sulle risposte anticorpali degli individui a 5 e 12 mesi e ha studiato l’incidenza della malaria durante due diversi periodi di rischio, da 5 a 12 mesi e da 12 a 24 mesi. Nella loro analisi, hanno notato un modello distinto per le sottoclassi IgG dell’antigene EBA-175: concentrazioni più elevate di particolari anticorpi noti come neutralizzanti IgG1 e IgG3 erano legate a una ridotta probabilità di contrarre la malaria nel secondo anno. Poiché i livelli di IgG1 sono raddoppiati, il rischio di malaria è stato ridotto di circa il 50%, e quando i livelli di IgG3 sono raddoppiati, il rischio di malaria è diminuito di circa il 60% [115].
È importante notare che la probabilità di contrarre la malaria è aumentata di circa tre volte quando i livelli di IgG4 non neutralizzanti sono raddoppiati. Fino all’età di 24 mesi, IgG1 e IgG3 hanno dimostrato rispettivamente effetti protettivi del 51% e del 56%; tuttavia, IgG4 era collegato a un rischio più elevato di infezione da malaria in questa fascia di età [115]. È interessante notare che uno studio separato ha anche trovato un legame tra alti livelli di IgG4 e un rischio più elevato di esacerbazioni di infezione e malaria [121]. Ciò implica che IgG4 blocca la citotossicità delle cellule IgG2-dipendenti causata da monociti o altre cellule effettrici. I livelli di IgG4 e la probabilità di infezione da malaria sono stati entrambi associati alla stagione di trasmissione della malaria. Il fatto che le concentrazioni di IgG4 siano aumentate significativamente durante la stagione di trasmissione e che l’aumento sia stato maggiore negli individui più giovani rispetto agli individui più anziani supporta anche una funzione di blocco delle IgG4 [121]. Inoltre, è stato dimostrato che IgG4 impedisce l’opsonizzazione di eritrociti infetti da parte di IgG1 e IgG3 in vitro [122].
3.3. Il tipo di vaccino utilizzato
Le risposte IgG4 sono state riportate raramente con altri vaccini, anche dopo numerose inoculazioni, tra cui quella del vaccino contro il tossoide tetanico (TT) e il virus respiratorio sinciziale (RSV) [30]. Questi risultati forniscono supporto alla proposta che il cambio di classe IgG4 non è un risultato comune dell’esposizione ripetuta all’antigene da immunizzazioni contro altri virus o malattie [30]. Anche se l’infezione naturale con il virus del morbillo può generare anticorpi IgG4 specifici [123], anche le infezioni virali persistenti come il citomegalovirus umano (HCMV) non producono un’elevata quantità di anticorpi IgG4 [124].
Uno studio pubblicato di recente ha scoperto che le risposte IgG4 a lungo termine sono state prodotte dai vaccini mRNA ma non dai vaccini che utilizzano adenovirus [31]. È interessante notare che due vaccini mRNA, insieme a un’inoculazione AZD1222 (AstraZeneca) con un richiamo mRNA, e in particolare il vaccino mRNA-1273, hanno causato risposte prolungate anti-S1 IgG4 in soggetti non infetti. Tuttavia, i ricercatori non sono stati in grado di rilevare questo aumento dopo due dosi del vaccino AZD1222 in individui non infetti fino al giorno 270, dimostrando che solo i vaccini mRNA hanno indotto risposte IgG4 rilevabili e prolungate fino al giorno 270. È importante sottolineare che, nei pazienti che avevano una precedente infezione da COVID-19 (prima della vaccinazione), le IgG4 non sono aumentate, anche dopo le iniezioni di mRNA, il che implica che quelli con livelli più elevati di IgG4 sono persone non infette che sono state immunizzate con vaccini mRNA prima di avere la loro infezione COVID-19 [31].
Ulteriori analisi della letteratura mostrano che solo i vaccini che utilizzano una parte del virus hanno prodotto un aumento dei livelli di IgG4 (la proteina spike per i vaccini mRNA, la proteina gp120 per l’HIV e l’antigene EBA-175 per il vaccino contro la malaria, rispettivamente). È interessante notare che Buhre et al. [31] hanno scoperto che il vaccino adenovirale basato su vettori di AstraZeneca non ha suscitato un tale aumento dei livelli di IgG4. Inoltre, altri studi hanno dimostrato che i vaccini acellulari (aP) ma non interi contro la pertosse (wP) inducono la produzione di anticorpi IgG4, che era anche correlata all’immunità compromessa. È stato dimostrato che i bambini iniettati con vaccini wP avevano maggiori risposte plasmacellulari totali e IgG1+ rispetto a quelli iniettati con un vaccino aP [125]. Secondo i risultati presentati al Congresso dell’Associazione mondiale per le malattie infettive e i disturbi immunitari (WAidid) [126], i bambini che avevano ricevuto un vaccino aP alla loro immunizzazione primaria avevano livelli di IgG4 significativamente più alti rispetto ai bambini che avevano ricevuto un vaccino wP. Poiché gli anticorpi IgG4 non sono in grado di attivare il sistema del complemento e, di conseguenza, di innescare la fagocitosi anticorpo-dipendente [39], è fondamentale per l’efficacia di un vaccino contro la pertosse generare un ampio arsenale di anticorpi, con gli anticorpi IgG1 più efficaci degli anticorpi IgG4 [126].
4. Discussione
Studi recenti hanno sollevato preoccupazioni sul fatto che l’inoculazione con vaccini COVID-19 basati su mRNA potrebbe comportare l’istituzione di tolleranza contro la proteina spike generata dalle cellule ospiti in risposta alla vaccinazione. Ad esempio, un recente lavoro di Irrgang et al. ha scoperto che diversi mesi dopo la seconda immunizzazione con il vaccino Pfizer, gli anticorpi specifici per SARS-CoV-2 erano composti principalmente da anticorpi IgG4 non neutralizzanti, che sono stati ulteriormente potenziati da una terza vaccinazione mRNA e / o infezioni rivoluzionarie della variante SARS-CoV-2 [30]. Gli autori hanno commentato che “indipendentemente dal meccanismo sottostante, l’induzione di anticorpi antivirali IgG4 è un fenomeno raramente descritto e solleva importanti domande sulle sue conseguenze funzionali” [30]. Gli anticorpi IgG4 sono bifunzionali: possono essere protettivi ma possono anche essere direttamente patogeni [127]. Ci sono state molte ricerche su IgG4 in modelli di esposizione cronica agli allergeni, dove la tolleranza immunologica naturale è indotta dando un allergene in dosi crescenti [128]. L’aumento dei livelli di IgG4 dopo la terza immunizzazione con il vaccino Pfizer potrebbe riflettere un meccanismo di tolleranza che potrebbe prevenire l’eccessiva reattività immunitaria (tempesta di citochine) e la progressione verso uno stadio critico [30]. Tuttavia, questa reazione immunitaria esacerbata non si verifica in persone giovani e sane, ed è stata documentata solo nei pazienti più anziani con suscettibilità genetica e in quelli con comorbidità [129].
È stato suggerito che un aumento dei livelli di IgG4 potrebbe avere un ruolo protettivo simile a quello che si verifica durante l’immunoterapia allergenico-specifica di successo inibendo gli effetti indotti da IgE [30]. La tolleranza agli allergeni è un adattamento del sistema immunitario caratterizzato da una particolare risposta non infiammatoria a un allergene che, in altre condizioni, probabilmente comporterebbe un’immunità cellulo-mediata o umorale, che causerebbe infiammazione tissutale e / o sintesi di IgE [128]. In altre parole, il sistema immunitario “impara” a tollerare un antigene estraneo, sebbene innocuo. Tuttavia, una situazione molto diversa si verifica quando un virus invade il nostro corpo. In questo scenario, la tolleranza indotta dal vaccino può potenzialmente avere diverse conseguenze negative e non intenzionali perché la tolleranza alla proteina spike potrebbe inibire il sistema immunitario dal rilevare e attaccare il patogeno (Figura 4); quindi, potenzialmente esacerbando la patologia SARS-CoV2 in individui suscettibili che soffrono di reinfezione di COVID-19 nel contesto della soppressione immunitaria indotta dal vaccino. Ad esempio, è stato dimostrato che i pazienti con COVID-19 grave deceduti avevano livelli di IgG4 più elevati rispetto a quelli che si sono ripresi [28]. Più precisamente, il tasso di mortalità è aumentato notevolmente a 30 giorni quando le concentrazioni sieriche di IgG4 erano superiori a 700 mg / dL e il rapporto tra IgG4 e IgG1 era superiore a 0,05 [29]. Inoltre, i livelli di IgG4 erano correlati con i livelli di IL-6 [130], un noto determinante della mortalità correlata a COVID-19 [130,131,132].
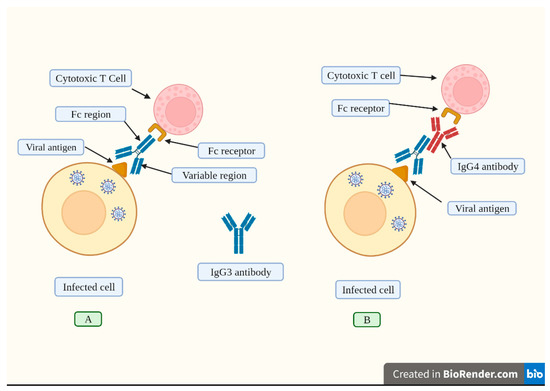
Figura 4. Una risposta umorale efficace indotta dalla vaccinazione consiste nella sintesi di alte concentrazioni di IgG3. (A). Gli anticorpi IgG3 si legano agli antigeni virali esposti sulle membrane delle cellule infette attraverso la sua regione variabile. Questo anticorpo ha una regione costante (Fc) che viene riconosciuta dal recettore corrispondente trovato sulle cellule T citotossiche e altre cellule immunitarie. La cellula T citotossica si attiva e rilascia agenti chimici che distruggono la cellula infetta. (B). La vaccinazione ripetuta induce alti livelli di IgG4 (raffigurati in rosso). Questo anticorpo inibisce l’attaccamento della regione Fc dall’anticorpo IgG3 al suo recettore situato sulle cellule T citotossiche, bloccando così la sua attivazione e, di conseguenza, la cellula infetta non viene distrutta. In questo senso, il potenziamento ripetuto provoca un passaggio alla produzione di alti livelli di IgG4, che compromettono le risposte immunitarie. Creato con Biorender.
Questo ci porta a concludere che non è corretto confrontare l’aumento dei livelli di IgG4 tra i trattamenti allergologici e l’aumento riportato degli anticorpi IgG4 dopo ripetute vaccinazioni o infezioni da SARS-CoV-2. La tolleranza indotta contro la proteina spike potrebbe produrre una risposta immunitaria compromessa contro il virus quando questi pazienti subiscono una reinfezione. Sebbene le nuove sottovarianti di Omicron abbiano un alto tasso di trasmissibilità, la gravità delle infezioni è stata fortunatamente ridotta a seguito di un cambiamento nell’affinità verso il tratto respiratorio superiore [27,133,134,135]. Questi risultati possono spiegare perché le infezioni da Omicron hanno causato meno effetti gravi [136,137]. Tuttavia, senza un adeguato livello di protezione, anche le nuove sottovarianti di Omicron (considerate lievi) potrebbero causare gravi danni multiorgano e morte in individui immunocompromessi e con comorbidità.
Uno studio di Gazit et al. ha rilevato che quando l’evento iniziale (infezione o vaccinazione) si è verificato tra gennaio e febbraio del 2021, i vaccinati naïve al SARS-CoV-2 hanno mostrato un rischio maggiore di 13,06 volte (intervallo di confidenza al 95% (CI), 8,08-21,11) di infezione da rottura con la variante Delta rispetto alle persone non vaccinate precedentemente infette. Anche l’aumento del rischio di malattia sintomatica era sostanziale. L’evidenza di un’immunità decrescente generata naturalmente è stata mostrata quando l’infezione si è verificata in qualsiasi momento tra marzo 2020 e febbraio 2021, sebbene i vaccinati naïve al SARS-CoV-2 avessero ancora un rischio maggiore di 5,96 volte (IC 95%: 4,85-7,33) di infezione da rottura e un rischio 7,13 volte (IC 95%: 5,51-9,21) più elevato di malattia sintomatica. Questa ricerca ha anche dimostrato che l’immunità acquisita attraverso la malattia naturale fornisce una migliore protezione contro l’infezione e i sintomi della malattia causati dalla variante Delta di SARS-CoV-2 rispetto all’immunità fornita da due iniezioni con il vaccino BNT162b2 [138].
Anche la protezione che i vaccini COVID-19 forniscono contro i sintomi gravi e l’ospedalizzazione viene ora messa in discussione a seguito di un focolaio in un ospedale israeliano che ha provocato la morte di cinque individui (tutti con comorbilità) che erano completamente immunizzati [138]. Questo studio getta qualche dubbio sull’idea che l’immunizzazione diffusa produrrà l’immunità di gregge e fermerà le epidemie di COVID-19. Questo potrebbe essere stato vero per il virus wild-type SARS-CoV-2, ma nell’epidemia oggetto dello studio citato, il 96,2% di coloro che sono stati esposti ha ricevuto vaccinazioni complete [139]. Allo stesso modo, Brosh-Nissimov et al. hanno riferito che tra 17 ospedali israeliani, 34/152 (22%) pazienti completamente immunizzati sono morti a causa di COVID-19. Evidentemente, questi individui avevano un’alta prevalenza di disturbi comorbili, come insufficienza cardiaca congestizia, insufficienza renale cronica, ipertensione, diabete e disturbi polmonari, che li rendevano più vulnerabili allo sviluppo di COVID-19 grave [140].
Irrgang et al. [30] hanno riferito che ci vogliono mesi prima che il cambio di classe IgG4 si sviluppi. Questo aumento dei livelli di IgG4 potrebbe spiegare la ridotta efficacia dei vaccini mRNA rilevati dopo 6 mesi [141]? Sulla base dei risultati dello studio HIV [113], in cui la diminuzione dell’efficacia del vaccino era legata alla produzione di IgG4, concludiamo che la vaccinazione ripetuta con mRNA è anche correlata con una ridotta efficacia nel proteggere le persone dalla reinfezione a causa di un aumento dei livelli di IgG4.
Ci sono ora prove convincenti che, tra i vaccini COVID-19, solo i vaccini mRNA (ma non il vaccino basato su vettori adenovirali di AstraZeneca) hanno indotto un notevole aumento dei livelli di IgG4 e tale aumento è stato rilevato in individui non infetti da SARS-CoV-2 che hanno ricevuto vaccinazioni mRNA prima di essere infettati dal virus, mentre per i pazienti che avevano avuto una precedente infezione prima della vaccinazione, I livelli di IgG4 non sono aumentati [31]. Ciò è in contrasto con i risultati di un altro studio che mostra che i più alti livelli di IgG4 sono stati trovati in quegli individui che hanno sviluppato un’infezione rivoluzionaria dopo aver ricevuto tre dosi di vaccinazione mRNA, indicando che le infezioni da SARS-CoV-2 possono anche indurre la produzione di IgG4 [30]. Suggeriamo che siano necessarie ulteriori ricerche per una conclusione definitiva su questi diversi risultati.
Gli studi sull’HIV [113] e sulla malaria [115] e gli studi con il vaccino contro la pertosse ci hanno informato che la vaccinazione ripetuta era legata a una ridotta protezione dall’infezione e questa scarsa risposta era direttamente correlata a una maggiore produzione di IgG4. Inoltre, è stato suggerito che questo cambio di classe potrebbe contribuire a infezioni rivoluzionarie a causa di risposte antivirali mediate da fc compromesse [113]. Tutto sommato, i dati esaminati indicano che la produzione di IgG4 indotta da vaccinazioni ripetute non costituisce in alcun modo un meccanismo protettivo. Ci sono anche segnali di avvertimento nella letteratura recente che indicano che la risposta immunitaria cellulare indotta dal tipico ciclo di vaccinazione può essere gravemente compromessa dalla somministrazione ripetuta dello stesso richiamo o infezione dopo la vaccinazione, che, in combinazione con una ridotta risposta immunitaria anticorpale, può causare il peggioramento dei sintomi dei riceventi o la loro malattia a durare più a lungo. È probabile che una vaccinazione eccessiva crei un microambiente immunosoppressivo che è cruciale per promuovere la tolleranza immunologica. Questi risultati mostrano che l’immunizzazione ripetuta di richiamo di SARS-CoV-2 in popolazioni dense dovrebbe essere affrontata con cautela [112].
Proponiamo un ipotetico meccanismo di tolleranza immunitaria indotto dai vaccini mRNA, che potrebbe avere almeno sei conseguenze negative non intenzionali:
(1) Ignorando la proteina spike sintetizzata come conseguenza della vaccinazione, il sistema immunitario dell’ospite può diventare vulnerabile alla reinfezione con le nuove sottovarianti di Omicron, consentendo la libera replicazione del virus una volta che si verifica una reinfezione. In questa situazione, suggeriamo che anche queste sottovarianti di Omicron meno patogene potrebbero causare danni significativi e persino la morte in individui con comorbidità e condizioni immuno-compromesse.
(2) L’mRNA e i vaccini inattivati alterano temporaneamente la segnalazione dell’interferone [142,143], causando probabilmente soppressione immunitaria e lasciando l’individuo in una situazione vulnerabile contro qualsiasi altro agente patogeno. Inoltre, questa soppressione immunitaria potrebbe consentire la riattivazione di infezioni virali, batteriche o fungine latenti e potrebbe anche consentire la crescita incontrollata delle cellule tumorali [144].
(3) Un sistema immunitario tollerante potrebbe consentire la persistenza di SARS-CoV-2 nell’ospite e promuovere l’instaurarsi di un’infezione cronica, simile a quella generata dal virus dell’epatite B (HBV), dal virus dell’immunodeficienza umana (HIV) e dal virus dell’epatite C (HCV) [145].
(4) La soppressione immunitaria combinata (prodotta dall’infezione da SARS-CoV-2 [15,16,17,18,19,20,21,22] e ulteriormente potenziata dalla vaccinazione [142,143,144]) potrebbe spiegare una pletora di condizioni autoimmuni, come tumori, reinfezioni e decessi temporalmente associati a entrambi. È concepibile che l’eccesso di decessi riportato in diversi paesi altamente vaccinati contro il COVID-19 possa essere spiegato, in parte, da questo effetto immunosoppressivo combinato.
(5) La vaccinazione ripetuta potrebbe anche portare all’autoimmunità: nel 2009, i risultati di un importante studio sono passati in gran parte inosservati. I ricercatori hanno scoperto che nei topi che altrimenti non sono suscettibili a disturbi autoimmuni spontanei, la somministrazione ripetuta dell’antigene promuove l’autoimmunità sistemica. Lo sviluppo di cellule T CD4+ che possono indurre autoanticorpi (cellule T CD4+ che inducono autoanticorpi o cellule T aiCD4+), che hanno modificato i loro recettori delle cellule T (TCR), è stato innescato da un’eccessiva stimolazione delle cellule T CD4+. La cellula T aiCD4+ è stata generata da una nuova modifica genetica del TCR piuttosto che da una reazione crociata. Le cellule T CD8+ eccessivamente stimolate le hanno indotte a svilupparsi in linfociti T citotossici (CTL) specifici per un antigene. Questi CTL sono stati in grado di maturare ulteriormente mediante la presentazione incrociata dell’antigene, quindi in quella situazione, hanno indotto un danno tissutale autoimmune simile al lupus eritematoso sistemico (LES) [146]. Secondo la teoria della criticità auto-organizzata, quando il sistema immunitario dell’ospite è continuamente sovrastimolato dall’esposizione all’antigene a concentrazioni superiori a quelle che la criticità auto-organizzata del sistema immunitario può tollerare, l’autoimmunità sistemica si verifica inevitabilmente [147].
È stato proposto che la quantità e la durata della proteina spike prodotta siano presumibilmente influenzate dalle maggiori concentrazioni di mRNA nel vaccino mRNA-1273 (100 μg) rispetto al vaccino BNT162b2 (30 μg) [31]. Pertanto, è probabile che la proteina spike prodotta in risposta alla vaccinazione con mRNA sia troppo alta e duri troppo a lungo nel corpo. Ciò potrebbe sopraffare la capacità del sistema immunitario, portando all’autoimmunità [146,147]. In effetti, diverse indagini hanno rilevato che l’immunizzazione COVID-19 è associata allo sviluppo di risposte autoimmuni [148,149,150,151,152,153,154,155,156,157,158,159,160,161,162,163,164,165,166].
(6) L’aumento dei livelli di IgG4 indotto da vaccinazioni ripetute potrebbe portare a miocardite autoimmune; è stato suggerito che gli anticorpi IgG4 possono anche causare una reazione autoimmune impedendo la capacità del sistema immunitario di essere soppresso dalle cellule T regolatorie [102]. I pazienti che usano inibitori del checkpoint immunitario da soli o in combinazione sono stati collegati a casi di miocardite acuta [103,104,105,106,107], a volte con conseguenze letali [102]. Poiché gli anticorpi anti-PD-1 sono di classe IgG4 e questi anticorpi sono anche indotti da ripetute vaccinazioni, è plausibile suggerire che una vaccinazione eccessiva potrebbe essere associata al verificarsi di un aumento del numero di casi di miocardite e morti cardiache improvvise.
Infine, questi risultati negativi non dovrebbero influenzare tutte le persone che hanno ricevuto questi vaccini mRNA. Gli individui con suscettibilità genetica, deficienze immunitarie e comorbidità sono probabilmente i più propensi ad essere colpiti. Tuttavia, ciò dà origine a un paradosso inquietante: se le persone più colpite dalla malattia COVID-19 (anziani, diabetici, ipertesi e immunocompromessi come quelli con HIV) sono anche più suscettibili a subire gli effetti negativi della ripetuta vaccinazione con mRNA, è quindi giustificato richiamarli? Poiché le sottovarianti di Omicron hanno dimostrato di essere meno patogene [133,134,135,136,137] e i vaccini mRNA non proteggono dalla reinfezione [14,138], i medici dovrebbero essere consapevoli dei possibili effetti dannosi sul sistema immunitario somministrando richiami.
Contributi dell’autore
Concettualizzazione, A.R.-C. e V.N.U.; validazione, A.R.-C., E.M.R., W.M. e V.N.U.; analisi formale, A.R.-C., W.M., E.M.R. e V.N.U.; ricerca bibliografica, A.R.-C., E.M.R. e V.N.U.; data curation, A.R.-C., E.M.R. e V.N.U.; scrittura — preparazione della bozza originale, A.R.-C. e V.N.U.; scrittura—revisione e redazione, A.R.-C., E.M.R., W.M. e V.N.U.; visualizzazione, A.R.-C.; supervisione, A.R.-C. e V.N.U. Tutti gli autori hanno letto e accettato la versione pubblicata del manoscritto.
Finanziamento
Questa ricerca non ha ricevuto finanziamenti esterni.
Dichiarazione del Comitato di revisione istituzionale
Non applicabile.
Dichiarazione di consenso informato
Non applicabile.
Dichiarazione di disponibilità dei dati
Non applicabile.
Riconoscimenti
Gli autori desiderano ringraziare Angela Rothen per il suo prezioso aiuto con l’editing inglese.
Conflitti di interesse
Gli autori non dichiarano alcun conflitto di interessi.
Referenze
- Verbeke, R.; Lentacker, I.; De Smedt, S.C.; Dewitte, H. L’alba dei vaccini mRNA: il caso COVID-19. J. Controllo. Versione 2021, 333, 511–520. [Google Scholar] [CrossRef] [PubMed]
- Lauring, A.S.; Tenforde, M.W.; Chappell, J.D.; Gaglani, M.; Ginde, A.A.; McNeal, T.; Ghamande, S.; Douin, D.J.; Talbot, H.K.; Casey, J.D. Gravità clinica ed efficacia dei vaccini mRNA contro, COVID-19 da varianti omicron, delta e alfa SARS-CoV-2 negli Stati Uniti: studio osservazionale prospettico. BMJ 2022, 376, e069761. [Google Scholar] [CrossRef] [PubMed]
- Tenforde, M.W.; Sé, W.H.; Gaglani, M.; Ginde, A.A.; Douin, D.J.; Talbot, H.K.; Casey, J.D.; Mohr, N.M.; Zepeski, A.; McNeal, T. Efficacia della vaccinazione mRNA nella prevenzione della ventilazione meccanica invasiva associata a COVID-19 e della morte – Stati Uniti, marzo 2021-gennaio 2022. Morb. Mortale. Wkly. Rep. 2022, 71, 459. [Google Scholar] [CrossRef] [PubMed]
- Plumb, I.D.; Feldstein, L.R.; Barkley, E.; Posner, A.B.; Bregman, H.S.; Hagen, M.B.; Gerhart, J.L. Efficacia della vaccinazione mRNA COVID-19 nel prevenire l’ospedalizzazione associata a COVID-19 tra gli adulti con precedente infezione da SARS-CoV-2 – Stati Uniti, giugno 2021-febbraio 2022. Morb. Mortale. Wkly. Rep. 2022, 71, 549. [Google Scholar] [CrossRef]
- Rahmani, K.; Shavaleh, R.; Forouhi, M.; Disfani, H.F.; Kamandi, M.; Oskooi, R.K.; Foogerdi, M.; Soltani, M.; Rahchamani, M.; Mohaddespour, M. L’efficacia dei vaccini COVID-19 nel ridurre l’incidenza, l’ospedalizzazione e la mortalità da COVID-19: una revisione sistematica e una meta-analisi. Fronte. Sanità pubblica 2022, 10, 2738. [Google Scholar] [CrossRef]
- Tenforde, M.W.; Sé, W.H.; Adams, K.; Gaglani, M.; Ginde, A.A.; McNeal, T.; Ghamande, S.; Douin, D.J.; Talbot, H.K.; Casey, J.D. Associazione tra vaccinazione mRNA e ospedalizzazione COVID-19 e gravità della malattia. JAMA 2021, 326, 2043–2054. [Google Scholar] [CrossRef]
- Tassi di casi e decessi COVID-19 per stato di vaccinazione. Centri per il controllo delle malattie. Tracker dati COVID-19. Disponibile online: https://covid.cdc.gov/covid-data-tracker/#rates-by-vaccine-status (consultato il 16 maggio 2022).
- Decessi per stato di vaccinazione in Inghilterra. Ufficio nazionale di statistica. Disponibile online: https://www.ons.gov.uk/peoplepopulationandcommunity/birthsdeathsandmarriages/deaths/datasets/deathsbyvaccinationstatusengland (consultato il 14 maggio 2023).
- Aarstad, J.; Kvitastein, O.A. Esiste un legame tra l’assorbimento della vaccinazione COVID-2021 del 19 in Europa e l’eccesso di mortalità per tutte le cause del 2022? Asian Pac. J. Health Sci. 2023, 10, 25–31. [Google Scholar]
- Polack, F.P.; Thomas, S.J.; Kitchin, N.; Absalon, J.; Gurtman, A.; Lockhart, S.; Perez, J.L.; Pérez Marc, G.; Moreira, E.D.; Zerbini, C. Sicurezza ed efficacia del vaccino BNT162b2 mRNA COVID-19. N. Engl. J. Med. 2020, 383, 2603–2615. [Google Scholar] [CrossRef]
- Seow, J.; Graham, C.; Merrick, B.; Attori, S.; Pickering, S.; Acciaio, K.J.; Hemmings, O.; O’Byrne, A.; Kouphou, N.; Galao, R.P. Osservazione longitudinale e declino delle risposte anticorpali neutralizzanti nei tre mesi successivi all’infezione da SARS-CoV-2 negli esseri umani. Microbiolo. 2020, 5, 1598–1607. [Google Scholar] [CrossRef]
- Wang, Z.; Schmidt, F.; Weisblum, Y.; Muecksch, F.; Barnes, C.O.; Finkin, S.; Schaefer-Babajew, D.; Cipolla, M.; Gaebler, C.; Lieberman, J.A. anticorpi indotti dal vaccino mRNA contro SARS-CoV-2 e varianti circolanti. Natura 2021, 592, 616-622. [Google Scholar] [CrossRef]
- Bartsch, Y.C.; Tong, X.; Kang, J.; Avendaño, M.J.; Serrano, E.F.; García-Salum, T.; Pardo-Roa, C.; Riquelme, A.; Cai, Y.; Renzi, I. Variante Omicron Il legame anticorpale spike-specifico e l’attività Fc sono preservati nei riceventi di mRNA o vaccini COVID-19 inattivati. Sci. Transl. Med. 2022, 14, EABN9243. [Google Scholar] [CrossRef]
- Subramanian, S.; Kumar, A. Gli aumenti di COVID-19 non sono correlati ai livelli di vaccinazione in 68 paesi e 2947 contee negli Stati Uniti. Eur. J. Epidemiol. 2021, 36, 1237–1240. [Google Scholar] [CrossRef] [PubMed]
- Oh, S.J.; Shin, O.S. SARS-CoV-2-mediato strategie di evasione per le vie di interferone antivirale. J. Microbiolo. 2022, 60, 290–299. [Google Scholar] [CrossRef] [PubMed]
- Lei, X.; Dong, X.; Ma, R.; Wang, W.; Xiao, X.; Tian, Z.; Wang, C.; Wang, Y.; Li, L.; Ren, L.; et al. Attivazione ed evasione delle risposte all’interferone di tipo I da parte di SARS-CoV-2. Nat. Commun. 2020, 11, 3810. [Google Scholar]
- Rashid, F.; Dzakah, E.E.; Wang, H.; Tang, S. La proteina ORF8 di SARS-CoV-2 ha indotto stress del reticolo endoplasmatico e ha mediato l’evasione immunitaria antagonizzando la produzione di interferone beta. Virus Res. 2021, 296, 198350. [Google Scholar] [CrossRef]
- Xia, H.; Cao, Z.; Xie, X.; Zhang, X.; Chen, J.Y.; Wang, H.; Menachery, V.D.; Rajsbaum, R.; Shi, P.Y. Evasione dell’interferone di tipo I da parte di SARS-CoV-2. 2020, 33, 108234. [Google Scholar] [PubMed]
- Han, L.; Zhuang, M.W.; Deng, J.; Zheng, Y.; Zhang, J.; Nan, M.L.; Zhang, X.J.; Gao, C.; Wang, P.H. SARS-CoV-2 ORF9b antagonizza gli interferoni di tipo I e III prendendo di mira più componenti delle vie di segnalazione RIG-I / MDA-5-MAVS, TLR3-TRIF e cGAS-STING. J. Med. Virol. 2021, 93, 5376–5389. [Google Scholar] [CrossRef] [PubMed]
- Kouwaki, T.; Nishimura, T.; Wang, G.; Oshiumi, H. RIG-I-Like riconoscimento mediato dal recettore dell’RNA genomico virale della sindrome respiratoria acuta grave coronavirus-2 e fuga virale dalle risposte immunitarie innate dell’ospite. Fronte. Immunol. 2021, 12, 700926. [Google Scholar] [CrossRef]
- Zhang, Y.; Chen, Y.; Li, Y.; Huang, F.; Luo, B.; Yuan, Y.; Xia, B.; Ma, X.; Yang, T.; Yu, F.; et al. La proteina ORF8 di SARS-CoV-2 media l’evasione immunitaria attraverso la down-regolazione MHC-I. Proc. Natl. Acad. Sci. USA 2021, 118, e2024202118. [Google Scholar] [CrossRef]
- Yoo, J.S.; Sasaki, M.; Cho, S.X.; Kasuga, Y.; Zhu, B.; Ouda, R.; Orba, Y.; de Figueiredo, P.; Sawa, H.; Kobayashi, K.S. SARS-CoV-2 inibisce l’induzione del pathway MHC di classe I prendendo di mira l’asse STAT1-IRF1-NLRC5. Nat. Commun. 2021, 12, 6602. [Google Scholar] [CrossRef]
- Merolli, A.; Kasaei, L.; Ramasamy, S.; Kolloli, A.; Kumar, R.; Subbian, S.; Feldman, L.C. Una via intra-citoplasmatica per la trasmissione di SARS-CoV-2 svelata dalla microscopia agli ioni di elio. Sci. Rep. 2022, 12, 3794. [Google Scholar] [CrossRef]
- Pepe, A.; Pietropaoli, S.; Vos, M.; Barba-Spaeth, G.; Zurzolo, C. I nanotubi a tunnel forniscono un percorso per la diffusione di SARS-CoV-2. Sci. Adv. 2022, 29, eabo0171. [Google Scholar]
- Saito, A.; Irie, T.; Suzuki, R.; Maemura, T.; Nasser, H.; Uriu, K.; Kosugi, Y.; Shirakawa, K.; Sadamasu, K.; Kimura, I.; et al. Aumento della fusogenicità e patogenicità della mutazione Delta P2R di SARS-CoV-681. Natura 2022, 602, 300-306. [Google Scholar] [CrossRef] [PubMed]
- Mlcochova, P.; Kemp, S.A.; Dhar, M.S.; Papa, G.; Meng, B.; Ferreira, I.; Datir, R.; Collier, D.A.; Albecka, A.; Singh, S.; SARS-CoV-2 B.1.617.2 Replicazione della variante Delta ed evasione immunitaria. Natura 2021, 599, 114-119. [Google Scholar]
- Meng, B.; Abdullahi, A.; Ferreira, I.A.; Goonawardane, N.; Saito, A.; Kimura, I.; Yamasoba, D.; Gerber, P.P.; Fatihi, S.; Rathore, S.; et al. L’uso alterato di TMPRSS2 da parte di SARS-CoV-2 Omicron influisce sull’infettività e sulla fusogenicità. Natura 2022, 603, 706-714. [Google Scholar] [CrossRef]
- Moura, A.D.; da Costa, H.H.; Correa, V.A.; de Lima, A.K.S.; Lindoso, J.A.; De Gaspari, E.; Hong, M.A.; Cunha-Junior, J.P.; Prudencio, C.R. Valutazione dell’avidità correlata alle sottoclassi IgG in pazienti infetti brasiliani con SARS-CoV-2. Sci. Rep. 2021, 11, 17642. [Google Scholar] [CrossRef]
- Della-Torre, E.; Lanzillotta, M.; Strollo, M.; Ramirez, G.A.; Dagna, L.; Tresoldi, M. Il livello sierico di IgG4 predice la mortalità correlata a COVID-19. Eur. J. Intern. Med. 2021, 93, 107–109. [Google Scholar] [CrossRef]
- Irrgang, P.; Gerling, J.; Kocher, K.; Lapuente, D.; Steininger, P.; Habenicht, K.; Wytopil, M.; Beileke, S.; Schäfer, S.; Zhong, J. Class passa agli anticorpi IgG4 non infiammatori e spike-specifici dopo ripetuta vaccinazione con mRNA SARS-CoV-2. Sci. 2022, 8, EADE2798. [Google Scholar]
- Buhre, J.S.; Pongracz, T.; Künsting, I.; Lixenfeld, A.S.; Wang, W.; Nouta, J.; Lehrian, S.; Schmelter, F.; Lunding, H.B.; Dühring, L. I vaccini mRNA contro SARS-CoV-2 inducono livelli di galattosilazione e sialilazione IgG Fc relativamente bassi a lungo termine, ma aumentano le risposte IgG4 a lungo termine rispetto a un vaccino a base di adenovirus. Fronte. Immunol. 2023, 13, 7835. [Google Scholar] [CrossRef]
- Grigio, H.M.; Kunkel, H.G. H catena sottogruppi di proteine del mieloma e normale 7S γ-globulina. J. Exp. 1964, 120, 253. [Google Scholar] [CrossRef]
- Terry, W.D.; Fahey, J.L. Sottoclassi di γ2-globuline umane basate sulle differenze nelle catene polipeptidiche pesanti. Science 1964, 146, 400–401. [Google Scholar] [CrossRef] [PubMed]
- Mayumi, M.; Kuritani, T.; Kubagawa, H.; Cooper, M. Espressione della sottoclasse IgG da parte dei linfociti B umani e delle plasmacellule: i linfociti B preimpegnati nella sottoclasse IgG possono essere indotti preferenzialmente da mitogeni policlonali con l’aiuto delle cellule T. J. Immunol. 1983, 130, 671–677. [Google Scholar] [CrossRef] [PubMed]
- Abbas, A.K.; Lichtman, A.H.; Pober, J.S. Immunologia cellulare e molecolare; Saunders: Filadelfia, PA, USA, 1991. [Google Scholar]
- Meulenbroek, A. Sottoclassi di IgG umane: marcatori diagnostici utili per l’immunocompetenza; CLB: Ottawa, ON, Canada, 2002. [Google Scholar]
- Aucouturier, P.; Danon, F.; Daveau, M.; Guillou, B.; Sabbah, A.; Besson, J.; Preud’homme, J.L. Misurazione dei livelli sierici di IgG4 mediante un saggio immunoenzimatico competitivo con anticorpi monoclonali. J. Immunol. Metodi 1984, 74, 151-162. [Google Scholar] [CrossRef] [PubMed]
- Aalberse, R.C.; Schuurman, J. IgG4 infrangere le regole. Immunologia 2002, 105, 9-19. [Google Scholar] [CrossRef]
- Aalberse, R.; Stapel, S.; Schuurman, J.; Rispens, T. Immunoglobulina G4: Un anticorpo strano. Allergia 2009, 39, 469-477. [Google Scholar] [CrossRef]
- Nirula, A.; Glaser, S.M.; Kalled, S.L.; Taylor, F.R. Cos’è IgG4? Una revisione della biologia di un sottotipo di immunoglobuline unico. Curr. Opin. Reumatolo. 2011, 23, 119–124. [Google Scholar] [CrossRef]
- Moriyama, M.; Tanaka, A.; Maehara, T.; Furukawa, S.; Nakashima, H.; Nakamura, sottogruppi di aiutanti S. T nella sindrome di Sjögren e dacrioadenite e sialoadenite correlate a IgG4: una revisione critica. J. Autoimmun. 2014, 51, 81–88. [Google Scholar] [CrossRef]
- Khosroshahi, A.; Pietra, J.H. Una panoramica clinica della malattia sistemica correlata a IgG4. Curr. Opin. Reumatolo. 2011, 23, 57–66. [Google Scholar] [CrossRef]
- Yang, X.; Wang, F.; Zhang, Y.; Wang, L.; Antonenko, S.; Zhang, S.; Zhang, Y.W.; Tabrizifard, M.; Ermakov, G.; Wiswell, D. Analisi completa dell’anticorpo terapeutico IgG4 pembrolizumab: la modifica della cerniera blocca lo scambio di mezze molecole in vitro e in vivo. J. Pharm. Sci. 2015, 104, 4002-4014. [Google Scholar] [CrossRef]
- Schuurman, J.; Van Ree, R.; Perdok, G.A.; Van Doorn, H.; Abbronzatura, K.; Aalberse, R. L’immunoglobulina umana normale G4 è bispecifica: ha due diversi siti di combinazione di antigeni. Immunologia 1999, 97, 693-698. [Google Scholar] [CrossRef]
- Van Der Neut Kolfschoten, M.; Schuurman, J.; Losen, M.; Bleeker, W.K.; Martínez-Martínez, P.; Vermeulen, E.; Den Bleker, T.H.; Wiegman, L.; Vink, T.; Aarden, L.A. Attività antinfiammatoria degli anticorpi IgG4 umani mediante scambio dinamico del braccio Fab. Science 2007, 317, 1554–1557. [Google Scholar] [CrossRef]
- Huijbers, M.G.; Plomp, J.J.; van der Maarel, S.M.; Verschuuren, J.J. Malattie autoimmuni mediate da IgG4: una nicchia di disturbi mediati da anticorpi. Ann. N. Y. Acad. Sci. 2018, 1413, 92–103. [Google Scholar] [CrossRef]
- Daveau, M.; Fischer, J.P.; Rivat, L.; Rivat, C.; Ropartz, C.; Peter, H.H.; Cesarini, J.-P.; Kourilsky, F.M. IgG4 subclass in malignant melanoma. J. Natl. Cancer Inst. 1977, 58, 189–192. [Google Scholar] [CrossRef]
- Karagiannis, P.; Gilbert, A.E.; Josephs, D.H.; Ali, N.; Dodev, T.; Saul, L.; Correa, I.; Roberts, L.; Beddowes, E.; Koers, A. IgG4 subclass antibodies impair antitumor immunity in melanoma. J. Clin. Investig. 2013, 123, 1457–1474. [Google Scholar] [CrossRef]
- Akdis, C.; Blaser, K. Mechanisms of allergen-specific immunotherapy. Allergy 2000, 55, 522–530. [Google Scholar] [CrossRef] [PubMed]
- Akdis, M. Healthy immune response to allergens: T regulatory cells and more. Curr. Opin. Immunol. 2006, 18, 738–744. [Google Scholar] [CrossRef] [PubMed]
- Larché, M.; Akdis, C.A.; Valenta, R. Immunological mechanisms of allergen-specific immunotherapy. Nat. Rev. Immunol. 2006, 6, 761–771. [Google Scholar] [CrossRef]
- Durham, S.R.; Walker, S.M.; Varga, E.-M.; Jacobson, M.R.; O’Brien, F.; Noble, W.; Till, S.J.; Hamid, Q.A.; Nouri-Aria, K.T. Long-term clinical efficacy of grass-pollen immunotherapy. N. Engl. J. Med. 1999, 341, 468–475. [Google Scholar] [CrossRef] [PubMed]
- Della-Torre, E.; Lanzillotta, M.a.; Doglioni, C. Immunology of IgG4-related disease. Clin. Exp. Immunol. 2015, 181, 191–206. [Google Scholar] [CrossRef] [PubMed]
- Aparisi, L.; Farre, A.; Gomez-Cambronero, L.; Martinez, J.; De Las Heras, G.; Corts, J.; Navarro, S.; Mora, J.; Lopez-Hoyos, M.; Sabater, L. Antibodies to carbonic anhydrase and IgG4 levels in idiopathic chronic pancreatitis: Relevance for diagnosis of autoimmune pancreatitis. Gut 2005, 54, 703–709. [Google Scholar] [CrossRef]
- Nishi, H.; Tojo, A.; Onozato, M.L.; Jimbo, R.; Nangaku, M.; Uozaki, H.; Hirano, K.; Isayama, H.; Omata, M.; Kaname, S. Anti-carbonic anhydrase II antibody in autoimmune pancreatitis and tubulointerstitial nephritis. Nephrol. Dial. Transplant. 2007, 22, 1273–1275. [Google Scholar] [CrossRef] [PubMed]
- Nishimori, I.; Miyaji, E.; Morimoto, K.; Nagao, K.; Kamada, M.; Onishi, S. Serum antibodies to carbonic anhydrase IV in patients with autoimmune pancreatitis. Gut 2005, 54, 274–281. [Google Scholar] [CrossRef] [PubMed]
- Asada, M.; Nishio, A.; Uchida, K.; Kido, M.; Ueno, S.; Uza, N.; Kiriya, K.; Inoue, S.; Kitamura, H.; Ohashi, S. Identification of a novel autoantibody against pancreatic secretory trypsin inhibitor in patients with autoimmune pancreatitis. Pancreas 2006, 33, 20–26. [Google Scholar] [CrossRef] [PubMed]
- Endo, T.; Takizawa, S.; Tanaka, S.; Takahashi, M.; Fujii, H.; Kamisawa, T.; Kobayashi, T. Amylase α-2A autoantibodies: Novel marker of autoimmune pancreatitis and fulminant type 1 diabetes. Diabetes 2009, 58, 732–737. [Google Scholar] [CrossRef] [PubMed]
- Frulloni, L.; Lunardi, C.; Simone, R.; Dolcino, M.; Scattolini, C.; Falconi, M.; Benini, L.; Vantini, I.; Corrocher, R.; Puccetti, A. Identification of a novel antibody associated with autoimmune pancreatitis. N. Engl. J. Med. 2009, 361, 2135–2142. [Google Scholar] [CrossRef]
- Hart, P.A.; Topazian, M.D.; Witzig, T.E.; Clain, J.E.; Gleeson, F.C.; Klebig, R.R.; Levy, M.J.; Pearson, R.K.; Petersen, B.T.; Smyrk, T.C. Treatment of relapsing autoimmune pancreatitis with immunomodulators and rituximab: The Mayo Clinic experience. Gut 2013, 62, 1607–1615. [Google Scholar] [CrossRef]
- Shiokawa, M.; Kodama, Y.; Kuriyama, K.; Yoshimura, K.; Tomono, T.; Morita, T.; Kakiuchi, N.; Matsumori, T.; Mima, A.; Nishikawa, Y. Pathogenicity of IgG in patients with IgG4-related disease. Gut 2016, 65, 1322–1332. [Google Scholar] [CrossRef]
- Vidarsson, G.; Dekkers, G.; Rispens, T. IgG subclasses and allotypes: From structure to effector functions. Front. Immunol. 2014, 5, 520. [Google Scholar] [CrossRef]
- Plomp, J.J.; Huijbers, M.G.; van der Maarel, S.M.; Verschuuren, J.J. Pathogenic IgG4 subclass autoantibodies in MuSK myasthenia gravis. Ann. N. Y. Acad. Sci. 2012, 1275, 114–122. [Google Scholar] [CrossRef]
- Beck Jr, L.H.; Salant, D.J. Membranous nephropathy: Recent travels and new roads ahead. Kidney Int. 2010, 77, 765–770. [Google Scholar] [CrossRef]
- Anhalt, G.J.; Labib, R.S.; Voorhees, J.J.; Beals, T.F.; Diaz, L.A. Induction of pemphigus in neonatal mice by passive transfer of IgG from patients with the disease. N. Engl. J. Med. 1982, 306, 1189–1196. [Google Scholar] [CrossRef] [PubMed]
- Yamamoto, M.; Ohara, M.; Suzuki, C.; Naishiro, Y.; Yamamoto, H.; Takahashi, H.; Imai, K. Elevated IgG4 concentrations in serum of patients with Mikulicz’s disease. Scand. J. Rheumatol. 2004, 33, 432–433. [Google Scholar] [CrossRef] [PubMed]
- Okazaki, K.; Uchida, K.; Koyabu, M.; Miyoshi, H.; Takaoka, M. Recent advances in the concept and diagnosis of autoimmune pancreatitis and IgG4-related disease. J. Gastroenterol. 2011, 46, 277–288. [Google Scholar] [CrossRef] [PubMed]
- Dahlgren, M.; Khosroshahi, A.; Nielsen, G.P.; Deshpande, V.; Stone, J.H. Riedel’s thyroiditis and multifocal fibrosclerosis are part of the IgG4-related systemic disease spectrum. Arthritis Care Res. 2010, 62, 1312–1318. [Google Scholar] [CrossRef] [PubMed]
- Zen, Y.; Inoue, D.; Kitao, A.; Onodera, M.; Abo, H.; Miyayama, S.; Gabata, T.; Matsui, O.; Nakanuma, Y. IgG4-related lung and pleural disease: A clinicopathologic study of 21 cases. Am. J. Surg. Pathol. 2009, 33, 1886–1893. [Google Scholar] [CrossRef]
- Inoue, D.; Zen, Y.; Abo, H.; Gabata, T.; Demachi, H.; Kobayashi, T.; Yoshikawa, J.; Miyayama, S.; Yasui, M.; Nakanuma, Y. Immunoglobulin G4–related lung disease: CT findings with pathologic correlations. Radiology 2009, 251, 260–270. [Google Scholar] [CrossRef]
- Saeki, T.; Saito, A.; Yamazaki, H.; Emura, I.; Imai, N.; Ueno, M.; Nishi, S.; Miyamura, S.; Gejyo, F. Tubulointerstitial nephritis associated with IgG4-related systemic disease. Clin. Exp. Nephrol. 2007, 11, 168–173. [Google Scholar] [CrossRef]
- Saeki, T.; Nishi, S.; Imai, N.; Ito, T.; Yamazaki, H.; Kawano, M.; Yamamoto, M.; Takahashi, H.; Matsui, S.; Nakada, S. Clinicopathological characteristics of patients with IgG4-related tubulointerstitial nephritis. Kidney Int. 2010, 78, 1016–1023. [Google Scholar] [CrossRef]
- Sato, Y.; Kojima, M.; Takata, K.; Morito, T.; Asaoku, H.; Takeuchi, T.; Mizobuchi, K.; Fujihara, M.; Kuraoka, K.; Nakai, T. Systemic IgG4-related lymphadenopathy: A clinical and pathologic comparison to multicentric Castleman’s disease. Mod. Pathol. 2009, 22, 589–599. [Google Scholar] [CrossRef]
- Sato, Y.; Notohara, K.; Kojima, M.; Takata, K.; Masaki, Y.; Yoshino, T. IgG4-related disease: Historical overview and pathology of hematological disorders. Pathol. Int. 2010, 60, 247–258. [Google Scholar] [CrossRef]
- Hamanou, H.; Kawa, S.; Ochi, Y.; Unno, H.; Shiba, N.; Wajiki, M.; Nakazawa, K.; Shimojo, H.; Kiyosawa, K. Hydronephrosis associated with retroperitoneal fibrosis and sclerosing pancreatitis. Lancet 2002, 359, 1403–1404. [Google Scholar] [CrossRef] [PubMed]
- Zen, Y.; Onodera, M.; Inoue, D.; Kitao, A.; Matsui, O.; Nohara, T.; Namiki, M.; Kasashima, S.; Kawashima, A.; Matsumoto, Y. Retroperitoneal fibrosis: A clinicopathologic study with respect to immunoglobulin G4. Am. J. Surg. Pathol. 2009, 33, 1833–1839. [Google Scholar] [CrossRef] [PubMed]
- Stone, J.H.; Khosroshahi, A.; Hilgenberg, A.; Spooner, A.; Isselbacher, E.M.; Stone, J.R. IgG4-related systemic disease and lymphoplasmacytic aortitis. Arthritis Rheum. 2009, 60, 3139–3145. [Google Scholar] [CrossRef]
- Evoli, A.; Tonali, P.A.; Padua, L.; Monaco, M.L.; Scuderi, F.; Batocchi, A.P.; Marino, M.; Bartoccioni, E. Clinical correlates with anti-MuSK antibodies in generalized seronegative myasthenia gravis. Brain 2003, 126, 2304–2311. [Google Scholar] [CrossRef]
- Farrugia, M.E.; Robson, M.D.; Clover, L.; Anslow, P.; Newsom-Davis, J.; Kennett, R.; Hilton-Jones, D.; Matthews, P.M.; Vincent, A. MRI and clinical studies of facial and bulbar muscle involvement in MuSK antibody-associated myasthenia gravis. Brain 2006, 129, 1481–1492. [Google Scholar] [CrossRef] [PubMed]
- McConville, J.; Farrugia, M.E.; Beeson, D.; Kishore, U.; Metcalfe, R.; Newsom-Davis, J.; Vincent, A. Detection and characterization of MuSK antibodies in seronegative myasthenia gravis. Ann. Neurol. 2004, 55, 580–584. [Google Scholar] [CrossRef]
- Niks, E.; Van Leeuwen, Y.; Leite, M.; Dekker, F.; Wintzen, A.; Wirtz, P.; Vincent, A.; van Tol, M.; Jol-van der Zijde, C.; Verschuuren, J. Clinical fluctuations in MuSK myasthenia gravis are related to antigen-specific IgG4 instead of IgG1. J. Neuroimmunol. 2008, 195, 151–156. [Google Scholar] [CrossRef]
- Ohta, K.; Shigemoto, K.; Fujinami, A.; Maruyama, N.; Konishi, T.; Ohta, M. Clinical and experimental features of MuSK antibody positive MG in Japan. Eur. J. Neurol. 2007, 14, 1029–1034. [Google Scholar] [CrossRef]
- Cole, R.N.; Reddel, S.W.; Gervásio, O.L.; Phillips, W.D. Anti-MuSK patient antibodies disrupt the mouse neuromuscular junction. Ann. Neurol. 2008, 63, 782–789. [Google Scholar] [CrossRef]
- Cole, R.; Ghazanfari, N.; Ngo, S.; Gervasio, O.; Reddel, S.; Phillips, W. Patient autoantibodies deplete postsynaptic muscle-specific kinase leading to disassembly of the ACh receptor scaffold and myasthenia gravis in mice. J. Physiol. 2010, 588, 3217–3229. [Google Scholar] [CrossRef]
- Klooster, R.; Plomp, J.J.; Huijbers, M.G.; Niks, E.H.; Straasheijm, K.R.; Detmers, F.J.; Hermans, P.W.; Sleijpen, K.; Verrips, A.; Losen, M. Muscle-specific kinase myasthenia gravis IgG4 autoantibodies cause severe neuromuscular junction dysfunction in mice. Brain 2012, 135, 1081–1101. [Google Scholar] [CrossRef] [PubMed]
- Selcen, D.; Fukuda, T.; Shen, X.-M.; Engel, A.G. Are MuSK antibodies the primary cause of myasthenic symptoms? Neurology 2004, 62, 1945–1950. [Google Scholar] [CrossRef] [PubMed]
- Zou, W.; Wolchok, J.D.; Chen, L. PD-L1 (B7-H1) and PD-1 pathway blockade for cancer therapy: Mechanisms, response biomarkers, and combinations. Sci. Transl. Med. 2016, 8, 328rv324. [Google Scholar] [CrossRef]
- Pardoll, D.M. The blockade of immune checkpoints in cancer immunotherapy. Nat. Rev. Cancer 2012, 12, 252–264. [Google Scholar] [CrossRef]
- Topalian, S.L.; Hodi, F.S.; Brahmer, J.R.; Gettinger, S.N.; Smith, D.C.; McDermott, D.F.; Powderly, J.D.; Carvajal, R.D.; Sosman, J.A.; Atkins, M.B. Safety, activity, and immune correlates of anti–PD-1 antibody in cancer. N. Engl. J. Med. 2012, 366, 2443–2454. [Google Scholar] [CrossRef] [PubMed]
- Brahmer, J.R.; Tykodi, S.S.; Chow, L.Q.; Hwu, W.-J.; Topalian, S.L.; Hwu, P.; Drake, C.G.; Camacho, L.H.; Kauh, J.; Odunsi, K. Safety and activity of anti–PD-L1 antibody in patients with advanced cancer. N. Engl. J. Med. 2012, 366, 2455–2465. [Google Scholar] [CrossRef]
- Hodi, F.S.; O’day, S.J.; McDermott, D.F.; Weber, R.W.; Sosman, J.A.; Haanen, J.B.; Gonzalez, R.; Robert, C.; Schadendorf, D.; Hassel, J.C. Improved survival with ipilimumab in patients with metastatic melanoma. N. Engl. J. Med. 2010, 363, 711–723. [Google Scholar] [CrossRef]
- Kamada, T.; Togashi, Y.; Tay, C.; Ha, D.; Sasaki, A.; Nakamura, Y.; Sato, E.; Fukuoka, S.; Tada, Y.; Tanaka, A.; et al. PD-1 regulatory T cells amplified by PD-1 blockade promote hyperprogression of cancer. Proc. Natl. Acad. Sci. USA 2019, 116, 9999–10008. [Google Scholar] [CrossRef+]
- Champiat, S.; Dercle, L.; Ammari, S.; Massard, C.; Hollebecque, A.; Postel-Vinay, S.; Chaput, N.; Eggermont, A.; Marabelle, A.; Soria, J.-C. La malattia iperprogressiva è un nuovo modello di progressione nei pazienti oncologici trattati con malattia iperprogressiva anti-PD-1/PD-L1 con terapia anti-PD-1/PD-L1. Clin. Cancro Res. 2017, 23, 1920–1928. [Google Scholar] [CrossRef]
- Kato, S.; Goodman, A.; Walavalkar, V.; Barkauskas, D.A.; Sharabi, A.; Kurzrock, R. Hyperprogressors dopo immunoterapia: analisi delle alterazioni genomiche associate al tasso di crescita acceleratoGenomica degli iperprogressori associati all’immunoterapia. Clin. Cancro Res. 2017, 23, 4242–4250. [Google Scholar] [CrossRef]
- Champiat, S.; Ferrara, R.; Massard, C.; Besse, B.; Marabelle, A.; Soria, J.-C.; Ferté, C. Malattia iperprogressiva: riconoscere un nuovo modello per migliorare la gestione del paziente. Rev. Clin. Oncol. 2018, 15, 748–762. [Google Scholar] [CrossRef]
- Harada, K.; Shimoda, S.; Kimura, Y.; Sato, Y.; Ikeda, H.; Igarashi, S.; Ren, X.S.; Sato, H.; Nakanuma, Y. Significato delle cellule immunoglobuline G4 (IgG4)-positive nel colangiocarcinoma extraepatico: meccanismo molecolare della reazione IgG4 nel tessuto tumorale. Epatologia 2012, 56, 157-164. [Google Scholar] [CrossRef] [PubMed]
- Yoneda, M.; Inada, H.; Kanayama, K.; Shiraishi, T. Un caso di adenocarcinoma duttale pancreatico con marcata infiltrazione con cellule IgG4-positive. J. Citol. 2013, 30, 46. [Google Scholar] [CrossRef] [PubMed]
- Lauw, F.N.; Pajkrt, D.; Hack, C.E.; Kurimoto, M.; van Deventer, S.J.; van der Poll, T. Effetti proinfiammatori di IL-10 durante l’endotossiemia umana. J. Immunol. 2000, 165, 2783–2789. [Google Scholar] [CrossRef] [PubMed]
- Nagata, K.; Nishiyama, C. IL-10 nelle risposte immunitarie mediate dai mastociti: ruoli antinfiammatori e proinfiammatori. Int. J. Mol. Sci. 2021, 22, 4972. [Google Scholar] [CrossRef]
- Saxton, R.A.; Tsutsumi, N.; Su, L.L.; Abhiraman, G.C.; Mohan, K.; Henneberg, L.T.; Aduri, N.G.; Gati, C.; Garcia, K.C. Disaccoppiamento basato sulla struttura delle funzioni pro- e anti-infiammatorie dell’interleuchina-10. Scienza 2021, 371, eabc8433. [Google Scholar] [CrossRef]
- Wang, H.; Xu, Q.; Zhao, C.; Zhu, Z.; Zhu, X.; Zhou, J.; Zhang, S.; Yang, T.; Zhang, B.; Li, J. Un meccanismo di evasione immunitaria con IgG4 che svolge un ruolo essenziale nel cancro e implicazioni per l’immunoterapia. J. Immunoterapia Cancro 2020, 8, e000661. [Google Scholar] [CrossRef]
- Matson, D.R.; Accola, M.A.; Rehrauer, W.M.; Corliss, R.F. Miocardite fatale dopo il trattamento con l’inibitore PD-1 nivolumab. J. Scienza forense. 2018, 63, 954–957. [Google Scholar] [CrossRef]
- Varricchi, G.; Marone, G.; Mercurio, V.; Galdiero, M.R.; Bonaduce, D.; Tocchetti, C.G. Inibitori del checkpoint immunitario e tossicità cardiaca: un problema emergente. Curr. Med. Chem. 2018, 25, 1327–1339. [Google Scholar] [CrossRef]
- Heinzerling, L.; Ott, P.A.; Hodi, F.S.; Husain, A.N.; Tajmir-Riahi, A.; Tawbi, H.; Pauschinger, M.; Gajewski, T.F.; Lipson, E.J.; Luke, J.J. Cardiotossicità associata a CTLA4 e PD1 bloccando l’immunoterapia. J. Immunother. Cancro 2016, 4, 50. [Google Scholar] [CrossRef]
- Johnson, D.B.; Balko, J.M.; Compton, M.L.; Chalkias, S.; Gorham, J.; Xu, Y.; Hicks, M.; Puzanov, I.; Alessandro, M.R.; Bloomer, T.L. Miocardite fulminante con blocco del checkpoint immunitario combinato. N. Engl. J. Med. 2016, 375, 1749–1755. [Google Scholar] [CrossRef]
- Läubli, H.; Balmelli, C.; Bossard, M.; Pfister, O.; Glatz, K.; Zippelius, A. Insufficienza cardiaca acuta dovuta a miocardite autoimmune in trattamento con pembrolizumab per melanoma metastatico. J. Immunother. Cancro 2015, 3, 11. [Google Scholar] [CrossRef]
- Tadokoro, T.; Keshino, E.; Makiyama, A.; Sasaguri, T.; Ohshima, K.; Katano, H.; Mohri, M. Miocardite linfocitica acuta con anticorpo anti-PD-1 nivolumab. Circ. insufficienza cardiaca. 2016, 9, e003514. [Google Scholar] [CrossRef] [PubMed]
- Billeskov, R.; Beikzadeh, B.; Berzofsky, J.A. L’effetto della dose di antigene sull’esito del vaccino mirato alle cellule T. Hum. Vaccini immunother. 2019, 15, 407–411. [Google Scholar] [CrossRef] [PubMed]
- Keck, S.; Schmaler, M.; Ganter, S.; Wyss, L.; Oberle, S.; Huseby, E.S.; Zehn, D.; King, C.G. L’affinità dell’antigene e la dose dell’antigene esercitano influenze distinte sulla differenziazione delle cellule T CD4. Proc. Natl. Acad. Sci. USA 2014, 111, 14852–14857. [Google Scholar] [CrossRef]
- Scott, L.J.; McCormack, P.L. Antigene ridotto, vaccino combinato contro la difterite, il tetano e la pertosse acellulare, adsorbito (Boostrix) Una guida al suo uso come immunizzazione di richiamo a dose singola contro la pertosse. BioDrugs 2013, 27, 75-81. [Google Scholar] [CrossRef] [PubMed®]
- McCormack, P.L. Antigene ridotto, vaccino combinato contro la difterite, il tetano e la pertosse acellulare, adsorbito (Boostrix): una revisione delle sue proprietà e dell’uso come immunizzazione di richiamo a dose singola. Droghe 2012, 72, 1765-1791. [Google Scholar] [CrossRef] [PubMed®]
- Gao, F.-X.; Wu, R.-X.; Shen, M.-Y.; Huang, J.-J.; Li, T.-T.; Hu, C.; Luo, F.-Y.; Canzone, S.-Y.; Mu, S.; Hao, Y.-N. La vaccinazione di richiamo estesa contro SARS-CoV-2 RBD induce tolleranza immunitaria umorale e cellulare nei topi. Iscience 2022, 25, 105479. [Google Scholar] [CrossRef]
- Chung, A.W.; Ghebremichael, M.; Robinson, H.; Marrone, E.; Choi, I.; Lane, S.; Dugast, A.-S.; Schoen, M.K.; Rolland, M.; Suscovich, T.J. I profili effettori di Fc-polifunzionali mediati dalla selezione della sottoclasse IgG distinguono i vaccini RV144 e VAX003. Sci. Transl. Med. 2014, 6, 228ra238. [Google Scholar] [CrossRef]
- Karnasuta, C.; Akapirat, S.; Madnote, S.; Savadsuk, H.; Puangkaew, J.; Rittiroongrad, S.; Rerks-Ngarm, S.; Nitayaphan, S.; Pitisuttithum, P.; Kaewkungwal, J. Confronto delle risposte anticorpali indotte dai regimi di vaccinazione RV144, VAX003 e VAX004. AIDS Res. Hum. Retrovir. 2017, 33, 410–423. [Google Scholar] [CrossRef]
- Dobaño, C.; Quelhas, D.; Quintó, L.; Puyol, L.; Serra-Casas, E.; Sindaco, A.; Nhampossa, T.; Macete, E.; Aiutante, P.; Mandomando, I. Le risposte della sottoclasse IgG dipendenti dall’età al Plasmodium falciparum EBA-175 sono associate in modo differenziale all’incidenza della malaria nei bambini mozambicani. Clin. Vaccino Immunol. 2012, 19, 157–166. [Google Scholar] [CrossRef] [PubMed]
- Eisenhut, M. L’immunità agli stadi del sangue di Plasmodium falciparum dipende da un modello specifico di risposte della sottoclasse delle immunoglobuline a più antigeni dello stadio del sangue. Ipotesi 2007, 69, 804-808. [Google Scholar] [CrossRef] [PubMed]
- Mewono, L.; Maya, D.W.M.; Matsiegui, P.-B.; Agnandji, S.T.; Kendjo, E.; Barondi, F.; Issifou, S.; Kremsner, P.G.; Mavoungou, E. L’interleuchina-21 è associata agli anticorpi IgG1 e IgG3 contro l’antigene-175 legante gli eritrociti-peptide 4 del Plasmodium falciparum nei bambini gabonesi con malaria acuta falciparum. Eur. Cytokine Netw. 2008, 19, 30–36. [Google Scholar] [PubMed]
- Oeuvray, C.; Bouharoun-Tayoun, H.; Gras-Masse, H.; Bottius, E.; Kaidoh, T.; Aikawa, M.; Filgueira, M.-C.; Tartar, A.; Druilhe, P. Merozoite surface protein-3: A malaria protein inducing antibodies that promote Plasmodium falciparum killing by cooperation with blood monocytes. Blood 1994, 84, 1594–1602. [Google Scholar] [CrossRef]
- Roussilhon, C.; Oeuvray, C.; Müller-Graf, C.; Tall, A.; Rogier, C.; Trape, J.-F.; Theisen, M.; Balde, A.; Pérignon, J.-L.; Druilhe, P. Long-term clinical protection from falciparum malaria is strongly associated with IgG3 antibodies to merozoite surface protein 3. PLoS Med. 2007, 4, e320. [Google Scholar] [CrossRef]
- Stanisic, D.I.; Richards, J.S.; McCallum, F.J.; Michon, P.; King, C.L.; Schoepflin, S.; Gilson, P.R.; Murphy, V.J.; Anders, R.F.; Mueller, I. Immunoglobulin G subclass-specific responses against Plasmodium falciparum merozoite antigens are associated with control of parasitemia and protection from symptomatic illness. Infect. Immun. 2009, 77, 1165–1174. [Google Scholar] [CrossRef]
- Aucan, C.; Traoré, Y.; Tall, F.; Nacro, B.; Traoré-Leroux, T.; Fumoux, F.; Rihet, P. High immunoglobulin G2 (IgG2) and low IgG4 levels are associated with human resistance to Plasmodium falciparum malaria. Infect. Immun. 2000, 68, 1252–1258. [Google Scholar] [CrossRef]
- Groux, H.; Gysin, J. Opsonization as an effector mechanism in human protection against asexual blood stages of Plasmodium falciparum: Functional role of IgG subclasses. Res. Immunol. 1990, 141, 529–542. [Google Scholar] [CrossRef]
- Isa, M.B.; Martínez, L.; Giordano, M.; Passeggi, C.; de Wolff, M.C.; Nates, S. Comparison of immunoglobulin G subclass profiles induced by measles virus in vaccinated and naturally infected individuals. Clin. Vaccine Immunol. 2002, 9, 693–697. [Google Scholar] [CrossRef]
- Urban, M.; Winkler, T.; Landini, M.; Britt, W.; Mach, M. Epitope-specific distribution of IgG subclasses against antigenic domains on glycoproteins of human cytomegalovirus. J. Infect. Dis. 1994, 169, 83–90. [Google Scholar] [CrossRef]
- Diks, A.M.; Versteegen, P.; Teodosio, C.; Groenland, R.J.; de Mooij, B.; Buisman, A.M.; Torres-Valle, A.; Pérez-Andrés, M.; Orfao, A.; Berbers, G.A.M.; et al. Age and Primary Vaccination Background Influence the Plasma Cell Response to Pertussis Booster Vaccination. Vaccines 2022, 10, 136. [Google Scholar] [CrossRef] [PubMed]
- van der Lee, S.; Hendrikx, L.H.; Sanders, E.A.M.; Berbers, G.A.M.; Buisman, A.M. Whole-Cell or Acellular Pertussis Primary Immunizations in Infancy Determines Adolescent Cellular Immune Profiles. Front. Immunol. 2018, 9, 51. [Google Scholar] [CrossRef] [PubMed]
- Trampert, D.C.; Hubers, L.M.; van de Graaf, S.F.; Beuers, U. On the role of IgG4 in inflammatory conditions: Lessons for IgG4-related disease. Biochim. Biophys. Acta (BBA) Mol. Basis Dis. 2018, 1864, 1401–1409. [Google Scholar] [CrossRef] [PubMed]
- Pajno, G.; Barberio, G.; De Luca, F.; Morabito, L.; Parmiani, S. Prevention of new sensitizations in asthmatic children monosensitized to house dust mite by specific immunotherapy. A six-year follow-up study. Clin. Exp. Allergy 2001, 31, 1392–1397. [Google Scholar] [CrossRef] [PubMed]
- Angioni, R.; Sanchez-Rodriguez, R.; Munari, F.; Bertoldi, N.; Arcidiacono, D.; Cavinato, S.; Marturano, D.; Zaramella, A.; Realdon, S.; Cattelan, A. Age-severity matched cytokine profiling reveals specific signatures in COVID-19 patients. Cell Death Dis. 2020, 11, 957. [Google Scholar] [CrossRef]
- Della-Torre, E.; Campochiaro, C.; Cavalli, G.; De Luca, G.; Napolitano, A.; La Marca, S.; Boffini, N.; Da Prat, V.; Di Terlizzi, G.; Lanzillotta, M. Interleukin-6 blockade with sarilumab in severe COVID-19 pneumonia with systemic hyperinflammation: An open-label cohort study. Ann. Rheum. Dis. 2020, 79, 1277–1285. [Google Scholar] [CrossRef]
- Della-Torre, E.; Della-Torre, F.; Kusanovic, M.; Scotti, R.; Ramirez, G.A.; Dagna, L.; Tresoldi, M. Treating COVID-19 with colchicine in community healthcare setting. Clin. Immunol. 2020, 217, 108490. [Google Scholar] [CrossRef]
- Della-Torre, E.; Lanzillotta, M.; Campochiaro, C.; Cavalli, G.; De Luca, G.; Tomelleri, A.; Boffini, N.; De Lorenzo, R.; Ruggeri, A.; Rovere-Querini, P. Respiratory impairment predicts response to IL-1 and IL-6 blockade in COVID-19 patients with severe pneumonia and hyper-inflammation. Front. Immunol. 2021, 12, 675678. [Google Scholar] [CrossRef]
- Peacock, T.P.; Brown, J.C.; Zhou, J.; Thakur, N.; Sukhova, K.; Newman, J.; Kugathasan, R.; Yan, A.W.; Furnon, W.; De Lorenzo, G. The altered entry pathway and antigenic distance of the SARS-CoV-2 Omicron variant map to separate domains of spike protein. biorxiv 2022, 15, e0241955. [Google Scholar]
- McMahan, K.; Giffin, V.; Tostanoski, L.H.; Chung, B.; Siamatu, M.; Suthar, M.S.; Halfmann, P.; Kawaoka, Y.; Piedra-Mora, C.; Jain, N. Ridotta patogenicità della variante SARS-CoV-2 Omicron nei criceti. Med 2022, 3, 262–268.e4. [Google Scholar] [CrossRef]
- Willett, B.J.; Grove, J.; MacLean, O.A.; Wilkie, C.; De Lorenzo, G.; Furnon, W.; Cantoni, D.; Scott, S.; Logan, N.; Ashraf, S. SARS-CoV-2 Omicron è una variante di fuga immunitaria con una via di ingresso cellulare alterata. Microbiolo. 2022, 7, 1161–1179. [Google Scholar] [CrossRef]
- Shuai, H.; Chan, J.F.-W.; Hu, B.; Chai, Y.; Yuen, T.T.-T.; Yin, F.; Huang, X.; Yoon, C.; Hu, J.-C.; Liu, H. Replicazione attenuata e patogenicità di SARS-CoV-2 B. 1.1. 529 Omicron. Natura 2022, 603, 693-699. [Google Scholar] [CrossRef] [PubMed]
- Wolter, N.; Jassat, W.; Walaza, S.; Welch, R.; Moultrie, H.; Groome, M.; Amoako, D.G.; Everatt, J.; Bhiman, J.N.; Scheepers, C. Valutazione precoce della gravità clinica della variante omicron SARS-CoV-2 in Sud Africa: uno studio di collegamento dati. Lancet 2022, 399, 437-446. [Google Scholar] [CrossRef] [PubMed]
- Gazit, S.; Shlezinger, R.; Perez, G.; Lotan, R.; Peretz, A.; Ben-Tov, A.; Herzel, E.; Alapi, H.; Cohen, D.; Muhsen, K. Sindrome respiratoria acuta grave coronavirus 2 (SARS-CoV-2) immunità acquisita naturalmente contro immunità indotta dal vaccino, reinfezioni contro infezioni rivoluzionarie: uno studio di coorte retrospettivo. Clin. Infettare. Dis. 2022, 75, E545–E551. [Google Scholar] [CrossRef] [PubMed]
- Shitrit, P.; Zuckerman, N.S.; Mor, O.; Gottesman, B.-S.; Chowers, M. Focolaio nosocomiale causato dalla variante Delta SARS-CoV-2 in una popolazione altamente vaccinata, Israele, luglio 2021. Eurosurveillance 2021, 26, 2100822. [Google Scholar] [CrossRef] [PubMed]
- Brosh-Nissimov, T.; Orenbuch-Harroch, E.; Tagliaerba, M.; Elbaz, M.; Nesher, L.; Stein, M.; Maor, Y.; Cohen, R.; Hussein, K.; Weinberger, M. BNT162b2 vaccino breakthrough: caratteristiche cliniche di 152 pazienti COVID-19 ospedalizzati completamente vaccinati in Israele. Clin. Microbiolo. Infettare. 2021, 27, 1652–1657. [Google Scholar] [CrossRef]
- Nordström, P.; Ballin, M.; Nordström, A. Rischio di infezione, ospedalizzazione e morte fino a 9 mesi dopo una seconda dose di vaccino COVID-19: uno studio retrospettivo di coorte totale della popolazione in Svezia. Lancet 2022, 399, 814-823. [Google Scholar] [CrossRef]
- Liu, J.; Wang, J.; Xu, J.; Xia, H.; Wang, Y.; Zhang, C.; Chen, W.; Zhang, H.; Liu, D.; Zhu, R. Indagini complete hanno rivelato alterazioni fisiopatologiche coerenti dopo la vaccinazione con vaccini COVID-19. Cell Discov. 2021, 7, 99. [Google Scholar] [CrossRef]
- Ivanova, E.N.; Devlin, J.C.; Buus, T.B.; Koide, A.; Shwetar, J.; Cornelio, A.; Samanovic, M.I.; Herrera, A.; Mimitou, E.P.; Zhang, C. Il vaccino mRNA SARS-CoV-2 suscita una potente risposta immunitaria adattativa in assenza di infiammazione mediata da IFN osservata in COVID-19. MedRxiv 2021. [Google Scholar] [CrossRef]
- Seneff, S.; Nigh, G.; Kyriakopoulos, A.M.; McCullough, P.A. Soppressione immunitaria innata mediante vaccinazioni mRNA SARS-CoV-2: il ruolo di G-quadruplex, esosomi e microRNA. Toxicol. 2022, 164, 113008. [Google Scholar] [CrossRef]
- Zhou, Y.; Zhang, Y.; Moorman, J.P.; Yao, Z.Q.; Jia, Z.S. Viral (virus dell’epatite C, virus dell’epatite B, HIV) persistenza e omeostasi immunitaria. Immunologia 2014, 143, 319-330. [Google Scholar] [CrossRef] [PubMed]
- Tsumiyama, K.; Miyazaki, Y.; Shiozawa, S. Teoria della criticità auto-organizzata dell’autoimmunità. PLoS ONE 2009, 4, e8382. [Google Scholar] [CrossRef] [PubMed]
- Shiozawa, S. Causa del lupus eritematoso sistemico: una nuova teoria della criticità auto-organizzata dell’autoimmunità. L’esperto Rev. Clin. Immunol. 2011, 7, 715–717. [Google Scholar] [CrossRef] [PubMed]
- Gadi, S.R.; Brunker, P.A.; Al-Samkari, H.; Sykes, D.B.; Saff, R.R.; Lo, J.; Bendapudi, P.; Foglia, D.E.; Leaf, R.K. Grave anemia emolitica autoimmune dopo aver ricevuto il vaccino mRNA SARS-CoV-2. Trasfusione 2021, 61, 3267-3271. [Google Scholar] [CrossRef] [PubMed]
- Bril, F.; Al Diffalha, S.; Decano, M.; Fettig, D.M. Epatite autoimmune in via di sviluppo dopo il vaccino contro la malattia da coronavirus 2019 (COVID-19): causalità o incidente? J. Hepatol. 2021, 75, 222–224. [Google Scholar] [CrossRef]
- Watad, A.; De Marco, G.; Mahajna, H.; Druyan, A.; Eltity, M.; Hijazi, N.; Haddad, A.; Elias, M.; Zisman, D.; Naffaa, M.E. Riacutizzazioni immuno-mediate della malattia o malattia di nuova insorgenza in 27 soggetti dopo vaccinazione mRNA/DNA SARS-CoV-2. Vaccini 2021, 9, 435. [Google Scholar] [CrossRef]
- Portoghese, A.J.; Sunga, C.; Kruse-Jarres, R.; Gernsheimer, T.; Abkowitz, J. Recrudescenza della condizione ematologica autoimmune e mediata dal complemento dopo la vaccinazione SARS-CoV-2. Sangue Adv. 2021, 5, 2794–2798. [Google Scholar] [CrossRef]
- Ghielmetti, M.; Schaufelberger, H.D.; Mieli-Vergani, G.; Cerny, A.; Dayer, E.; Vergani, D.; Beretta-Piccoli, B.T. Epatite acuta autoimmune simile con anticorpo anti-mitocondriale atipico dopo vaccinazione mRNA COVID-19: una nuova entità clinica? J. Autoimmun. 2021, 123, 102706. [Google Scholar] [CrossRef]
- Vuille-Lessard, É.; Montani, M.; Bosch, J.; Semmo, N. Epatite autoimmune innescata dalla vaccinazione SARS-CoV-2. J. Autoimmun. 2021, 123, 102710. [Google Scholar] [CrossRef]
- Chamling, B.; Vehof, V.; Drakos, S.; Weil, M.; Stallo, P.; Vahlhaus, C.; Mueller, P.; Bietenbeck, M.; Reinecke, H.; Meier, C. Insorgenza di miocardite acuta simile all’infarto dopo la vaccinazione COVID-19: solo una coincidenza accidentale o piuttosto miocardite autoimmune associata alla vaccinazione? Clin. Res. Cardiol. 2021, 110, 1850–1854. [Google Scholar] [CrossRef]
- Clayton-Chubb, D.; Schneider, D.; Freeman, E.; Kemp, W.; Roberts, S. Commento alla lettera di Bril F et al. “Epatite autoimmune in via di sviluppo dopo la malattia da coronavirus 2019 (COVID-19) vaccino: causalità o incidente?”. J. Hepatol. 2021, 75, 1249–1250. [Google Scholar] [CrossRef] [PubMed]
- Minocha, P.K.; Meglio, D.; Singh, R.K.; Hoque, T. Recidiva di miocardite acuta temporalmente associata alla ricezione del vaccino contro la malattia da coronavirus mRNA 2019 (COVID-19) in un adolescente maschio. J. Pediatr. 2021, 238, 321–323. [Google Scholar] [CrossRef] [PubMed]
- Elrashdy, F.; Tambuwala, M.M.; Hassan, S.S.; Adadi, P.; Seyran, M.; Abd El-Aziz, T.M.; Rezaei, N.; Lal, A.; Aljabali, A.A.; Kandimalla, R. Radici di autoimmunità degli eventi trombotici dopo la vaccinazione COVID-19. Autoimmun. Rev. 2021, 20, 102941. [Google Scholar] [CrossRef]
- Garrido, I.; Lopes, S.; Simões, M.S.; Liberale, R.; Lopes, J.; Carneiro, F.; Macedo, G. Epatite autoimmune dopo il vaccino COVID-19, più che una coincidenza. J. Autoimmun. 2021, 125, 102741. [Google Scholar] [CrossRef] [PubMed]
- Chen, Y.; Xu, Z.; Wang, P.; Li, X.M.; Shuai, Z.W.; Sì, D.Q.; Pan, H.F. Fenomeni autoimmuni di nuova insorgenza post-COVID-19. Immunologia 2022, 165, 386-401. [Google Scholar] [CrossRef]
- Fatima, Z.; Reece, B.R.; Moore, J.S.; Mezzi, RT, Jr. Anemia emolitica autoimmune dopo vaccino COVID mRNA. J. Investig. Med. High Impact Case Rep. 2022, 10, 23247096211073258. [Google Scholar] [CrossRef]
- Mahroum, N.; Lavine, N.; Ohayon, A.; Seida, R.; Alrais, M.; Zoubi, M.; Bragazzi, N.L. Vaccini COVID-19 e il tasso di eventi avversi autoimmuni: approfondimenti da una revisione della letteratura. Fronte. Immunol. 2022, 13, 872683. [Google Scholar] [CrossRef]
- Finsterer, J. Effetti collaterali neurologici delle vaccinazioni SARS-CoV-2. Acta Neurol. Scand. 2022, 145, 5–9. [Google Scholar] [CrossRef]
- Garg, R.K.; Paliwal, V.K. Spettro di complicanze neurologiche a seguito di vaccinazione COVID-19. Neurol. Sci. 2022, 43, 3–40. [Google Scholar] [CrossRef]
- Kaulen, L.D.; Doubrovinskaia, S.; Mooshage, C.; Giordania, B.; Purrucker, J.; Haubner, C.; Seliger, C.; Lorenz, H.M.; Nagel, S.; Wildemann, B. Malattie autoimmuni neurologiche a seguito di vaccinazioni contro SARS-CoV-2: una serie di casi. Eur. J. Neurol. 2022, 29, 555–563. [Google Scholar] [CrossRef]
- Kwon, H.; Kim, T. Encefalite autoimmune dopo la vaccinazione ChAdOx1-S SARS-CoV-2. Neurol. Sci. 2022, 43, 1487–1489. [Google Scholar] [CrossRef] [PubMed]
- Ruggeri, R.; Giovanellla, L.; Campennì, A. Il vaccino SARS-CoV-2 può innescare l’autoimmunità tiroidea: esperienza di vita reale e revisione della letteratura. J. Endocrinolo. Investig. 2022, 45, 2283–2289. [Google Scholar] [CrossRef] [PubMed]
| Disclaimer/Nota dell’editore: Le dichiarazioni, le opinioni e i dati contenuti in tutte le pubblicazioni sono esclusivamente quelli dei singoli autori e contributori |