Bere vino moderatamente fa bene, lo dice la Scienza!
La ricerca italiana è stata pubblicata sulla rivista internazionale Nutrients
a cura di Massimiliano Spinella (tratto da ItalianMedicalNews e Nutrients)

La Scienza sostiene uno dei principi cardine della dieta mediterranea: bere in modo moderato del vino porta dei benefici all’organismo. Un gruppo di ricercatori italiani ha infatti lavorato a una pubblicazione sul consumo moderato di vino. Il lavoro è intitolato ‘Moderate Wine Consumption and Health: A Narrative Review’ ed è pubblicato sulla rivisita internazionale Nutrients.
Secondo questo studio, il vino, se consumato moderatamente, non solo non aumenta il rischio di malattie cronico-degenerative, ma apporta possibili benefici per la salute soprattutto nell’ambito della dieta mediterranea. Il vino, con una composizione ricca e originale in termini di polifenoli e antiossidanti, vede un’associazione protettiva tra un consumo da basso a moderato per le malattie cardiovascolari, il diabete di tipo 2 e i disturbi neurologici. “Chi beve vino, in particolare rosso e nella misura massima di due bicchieri al giorno, ha il 51% in meno di rischi cardiovascolari– sottolinea Attilio Giacosa, uno degli autori della ricerca. Inoltre presenta anche un calo del 30% dei rischi di declino intellettuale. Non c’è motivo di suggerire a coloro che bevono vino con moderazione di smettere di farlo”.
Un lavoro che si basa su 24 studi scientifici
La review si è posto l’obiettivo di rivalutare la relazione che sussiste tra tipo e dose di bevanda alcolica consumata rispetto alla riduzione o all’incremento del rischio di malattie. Ben gli 24 studi gli scientifici dedicati alla valutazione del consumo moderato del vino e i suoi effetti sulla salute, con ricerche effettuate sia su banche dati di letteratura scientifica (come PubMed) sia su lavori pubblicati tra il 2010 e il 2022. In particolare, 8 studi riguardavano le malattie cardiovascolari, 3 il diabete di tipo 2, 4 le malattie neurodegenerative, 5 il cancro e 4 la longevità.
Il lavoro che ne è scaturito descrive accuratamente la relazione del vino sia per quanto concerne la relazione con le principali patologie del nostro tempo (si pensi alle malattie cronico degenerative), sia per la sua relazione con la dieta Mediterranea, fornendo elementi di viticoltura e discute gli aspetti biochimici alla base degli effetti positivi dei nutraceutici che esso contiene.
‘Un modo mediterraneo di bere’
Secondo lo studio, inoltre, si può parlare di un ‘modo mediterraneo di bere’. Ovvero un modo legato alla longevità che prevede un’assunzione moderata di vino in età adulta soprattutto durante i pasti. Ma soprattutto una modalità che potrebbe rappresentare il modo migliore per diminuire gli effetti tossici dell’etanolo e contemporaneamente aumentare le difese antiossidanti/disintossicanti grazie all’effetto sinergico di un’ampia gamma di componenti bioattivi in grado di modulare le difese dell’organismo e proteggere dalle malattie croniche/degenerative.
Clicca qui per leggere l’estratto originale dello studio.
Ecco invece nel dettaglio la traduzione italiana della Ricerca. Buona Lettura!
Astratto
Sebbene
sia chiaramente stabilito che l’abuso di alcol è gravemente dannoso per la salute, molte evidenze epidemiologiche e cliniche sembrano sottolineare il ruolo protettivo di quantità moderate di alcol e in particolare di vino sulla salute. Questa revisione narrativa mira a rivalutare la relazione tra il tipo e la dose di bevanda alcolica e il rischio ridotto o aumentato di varie malattie, alla luce delle più recenti evidenze scientifiche. In particolare, sono stati valutati studi in vitro sulla modulazione delle vie biochimiche e sull’espressione genica dei componenti bioattivi del vino. Ventiquattro studi sono stati selezionati dopo le ricerche di PubMed, Scopus e Google Scholar per la valutazione del consumo moderato di alcol / vino e degli effetti sulla salute: otto studi riguardavano malattie cardiovascolari, tre riguardavano il diabete di tipo 2, quattro riguardavano malattie neurodegenerative, cinque riguardavano il cancro e quattro erano correlati alla longevità. È inclusa una breve discussione sulle pratiche viticole ed enologiche che possono influenzare il contenuto di componenti bioattivi nel vino. L’analisi indica chiaramente che il vino differisce dalle altre bevande alcoliche e il suo consumo moderato non solo non aumenta il rischio di malattie cronico-degenerative, ma è anche associato a benefici per la salute, in particolare se incluso in un modello di dieta mediterranea. Ovviamente, ogni sforzo deve essere fatto per promuovere l’educazione comportamentale per prevenire gli abusi, soprattutto tra i giovani.
Parole chiave:
consumo di vino; consumo di alcol; Dieta mediterranea; resveratrolo; Polifenoli dell’uva
1. Introduzione
Tutta la letteratura medica scientifica sottolinea chiaramente che l’abuso di alcol è gravemente dannoso per la salute. Questi risultati hanno portato molte organizzazioni sanitarie e istituzioni preposte alla prevenzione delle malattie e alla difesa della salute a suggerire misure volte a favorire il rigoroso contenimento del consumo di alcol fino all’eventuale raggiungimento dell’obiettivo zero alcol [1]. Tuttavia, molte evidenze epidemiologiche e cliniche sembrano sottolineare il ruolo protettivo di quantità moderate di alcol e in particolare di vino sulla salute [2].
Questa revisione narrativa mira a rivalutare la relazione tra il tipo di bevanda alcolica e la dose e la riduzione o l’aumento del rischio di varie malattie, alla luce delle più recenti evidenze scientifiche. In particolare, è stata analizzata la correlazione con patologie cardiovascolari, diabete di tipo 2, malattie neurologiche degenerative e longevità. Inoltre, particolare attenzione è stata dedicata al capitolo molto discusso sulla correlazione tra alcol/vino e rischio di cancro. Sono state analizzate le differenze tra vino e altre bevande alcoliche e sono state attentamente valutate la modulazione delle vie biochimiche e l’espressione genica dei componenti bioattivi del vino. Questo studio fornisce dati scientifici per adattare gli sforzi nell’educare i medici e il pubblico sulla relazione tra consumo di vino e esiti favorevoli della malattia.
L’obiettivo principale di questa rassegna narrativa è quello di fornire prove scientifiche concrete per guidare le istituzioni che devono stabilire delle linee guida sul consumo corretto e consapevole delle bevande alcoliche e in particolare del vino, al fine di non danneggiare la salute e anzi possibilmente di proteggerla e ridurre il rischio di varie malattie.
2. Strategia di ricerca bibliografica
La ricerca bibliografica è stata inizialmente condotta su database di letteratura scientifica (PubMed, Scopus, Google Scholar e Web of Science) concentrandosi sui seguenti termini MeSH: consumo moderato di alcol, polifenoli del vino, trans-resveratrolo, attività antiossidante, espressione genica, vie biochimiche, dieta mediterranea, modello di consumo. Gli articoli sottoposti a revisione paritaria dovevano essere scritti in inglese, disponibili in full text e pubblicati principalmente tra il 2010 e il 2022. Inoltre, sono stati inclusi documenti pubblicati prima del 2010 se rilevanti nel settore. Abbiamo cercato articoli di ricerca, recensioni o editoriali. Sono stati ottenuti molti articoli, alcuni dei quali non soddisfacevano esattamente il campo di interesse; Pertanto, lo screening è stato intrapreso da quattro autori indipendenti. Il disaccordo è stato risolto con la discussione e, se necessario, da un quinto autore indipendente.
La selezione degli studi epidemiologici è stata eseguita secondo Egger et al. [3] seguendo questi passaggi:
1. Configurazione del gruppo di lavoro: due operatori, esperti in epidemiologia clinica (uno in qualità di operatore metodologico e uno partecipante in qualità di operatore clinico).
2. Formulazione delle domande sulla base delle considerazioni indicate nell’abstract: la correlazione tra consumo moderato di alcol e vino e rischio di varie malattie (malattie cardiovascolari, diabete di tipo 2, malattie neurodegenerative, cancro) e longevità).
3. Riconoscimento degli studi rilevanti: la ricerca è stata condotta su PubMed, Scopus e Google Scholar come segue: (a) definizione delle parole chiave (alcol, vino, malattie cardiovascolari, diabete di tipo 2, malattie neurodegenerative, cancro, longevità), inserendo il campo di interesse dei documenti da ricercare, raggruppati tra virgolette (“…”), e utilizzati separatamente o in combinazione; (b) uso della variabile booleana (vero o falso) AND operatore, che consente di stabilire relazioni logiche tra concetti; c) modalità di ricerca: ricerca avanzata; d) limiti: i documenti pubblicati negli ultimi 22 anni (anche i documenti pubblicati prima del 2000 sono stati inclusi se erano rilevanti nel settore); Esseri umani; adulti; lingue: inglese; (e) ricerca manuale eseguita dai ricercatori esperti in nutrizione clinica attraverso la revisione di articoli, concentrandosi sul consumo di alcol e vino e sui rischi per la salute.
4. Pubblicato su riviste qualificate nell’Index Medicus.
5. Analisi e presentazione dei risultati: i paragrafi sulla correlazione tra consumo di vino da basso a moderato e salute, e i dati estrapolati dagli “studi rivisti” sono stati collocati in tabelle; In particolare, per ogni studio sono stati specificati l’autore, l’anno di pubblicazione e le caratteristiche dello studio.
6. È stata effettuata e discussa un’analisi dei rapporti sotto forma di revisione narrativa. All’inizio di ogni sezione vengono riportati il tipo di studi scelti e le parole chiave considerate. La figura 1 indica il diagramma di flusso della ricerca bibliografica sugli studi epidemiologici.
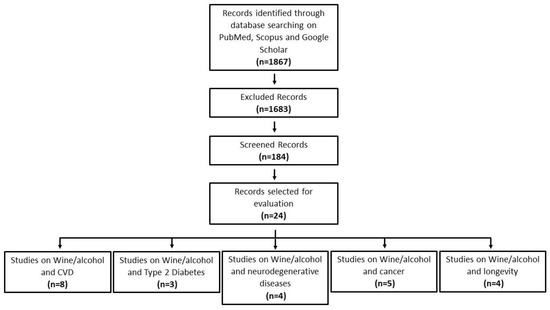
Figura 1. Diagramma di flusso della ricerca bibliografica sugli studi epidemiologici.
3. Ricerca continua per migliorare il profilo fenolico dell’uva e del vino
Il vino contiene molti composti bioattivi e tra questi i fenoli (antociani, flavoni, flavonoli, flavanoli, alchilfenoli, tirosoli, acidi fenolici, lignani, stilbeni) sono i più rappresentativi. Una panoramica sulla sintesi fenolica della vite, sul ruolo e sui fattori che influenzano la loro presenza nell’uva e nel vino è ben riportata [4,5]. Tra i fenoli, gli stilbeni saranno enfatizzati in questa sezione.
Gli stilbeni, nei tessuti molli (carnosi) come le bucce delle bacche, agiscono come fitoalessine (composti antifungini inducibili) poiché sono sintetizzati dalla pianta in risposta all’attacco di agenti patogeni; inoltre, alcuni elicitori abiotici (come ad esempio irradiazioni UV, ozono, fosetil-Al, metil jasmonato, oligomeri chitosani, ecc.) possono innescare la sintesi di stilbeni [6,7,8,9,10]. Molti composti stilbenici sono stati rilevati nell’uva e nel vino (resveratrolo, piceide, pterostilbene, viniferine, astringina, piceatannolo, trimeri e tetrameri di resveratrolo, ecc.). Il resveratrolo è lo stilbene più studiato e conosciuto e la produzione di uve e vini ad alto contenuto di resveratrolo si basa su una viticoltura orientata alla qualità (terroir adatti, pratiche colturali sostenibili) e su tecnologie di vinificazione che evitano il degrado del composto.
I livelli di resveratrolo dell’uva (e il suo glucoside-piceide) sono influenzati dal vitigno, dal clone, dalle condizioni meteorologiche, dal tipo di terreno e dalle pratiche colturali [11,12]. Di norma, maggiore è la concentrazione nell’uva, maggiore è la concentrazione nel vino.
Il resveratrolo è presente nelle uve mature di entrambe le varietà rosse e bianche, essendo più alto nelle bacche rosse rispetto a quelle bianche [13]. Anche il clone può svolgere un ruolo, come riportato in una prova in vaso o in vigna [14]. Più fresco rispetto alle condizioni più calde durante il periodo di maturazione aumenta le concentrazioni di bacche di resveratrolo, così come una maggiore elevazione del vigneto [15].
L’aumento dell’apporto di azoto ha un effetto negativo sui livelli di resveratrolo delle bacche, mentre l’apporto di calcio (tramite spray fogliare) ha un effetto positivo [16].
La rimozione delle foglie nella zona del grappolo all’invaiatura migliora i valori di resveratrolo negli anni più freddi (durante il periodo di maturazione), mentre negli anni più caldi si verifica il contrario.
Il diradamento dei grappoli migliora la concentrazione di resveratrolo del vino e la capacità antiossidante, mentre l’irrigazione (rispetto alla non irrigazione) riduce le concentrazioni di resveratrolo nell’uva [17].
È difficile confrontare i dati di concentrazione dell’uva di resveratrolo (dalla letteratura) come influenzati da elicitori biotici / abiotici e fattori viticoli, a causa dei diversi metodi di estrazione e unità di misura.
Secondo Bavaresco et al. [11] il resveratrolo è presente in quantità considerevolmente maggiore nei vini rossi rispetto ai vini bianchi perché è presente principalmente nella buccia degli acini, e i vini bianchi sono solitamente prodotti con macerazione nulla o limitata con le vinacce.
In una certa misura, le pratiche enologiche possono anche potenzialmente influenzare il resveratrolo nel vino, come le specie di lievito [18,19], il verificarsi della fermentazione malolattica [20], il tempo di macerazione [21], i livelli di agenti chiarificanti solitamente aggiunti per stabilizzare i vini rossi [22] e l’invecchiamento [23,24,25].
Inoltre, l’uso di specifiche tecniche post-vendemmia può modulare il resveratrolo e altri stilbeni nell’uva; ad esempio, le uve irradiate con raggi UV-C post-vendemmia sono una potenziale fonte per la produzione di vini rossi arricchiti con stilbene [26].
La più alta concentrazione di vino di resveratrolo totale, secondo la letteratura, è di 36 mg / L.
4. Composti bioattivi del vino: modulazione delle vie biochimiche e dell’espressione genica
Il vino è una soluzione idroalcolica complessa contenente una grande varietà di composti diversi; La maggior parte delle sue sostanze fitochimiche sono state isolate, identificate e studiate con l’obiettivo di identificare i responsabili di un effetto benefico sulla salute umana. La complessità del vino è estremamente difficile da riprodurre in vitro; Questa complessità e la moltitudine di componenti diverse permettono al vino di esercitare effetti biologici sinergici molto maggiori ed eterogenei rispetto a quelli eseguiti dai singoli componenti.
Come descritto da recenti revisioni sistematiche, la composizione fitochimica del vino dipende fortemente dall’interazione tra fattori ambientali, come il “terroir” un termine derivato dal latino, che definisce una specifica area geografica, con pratiche enologiche e di coltivazione dell’uva applicate che, nel complesso, definiscono le caratteristiche uniche di un determinato vino. Infatti, studi precedenti hanno riportato che i composti bioattivi del vino includono polifenoli come flavonoidi, (+)-catechina, quercetina e antociani e stilbeni come il resveratrolo (3, 5, 4′-triidrossistilbene) [27,28,29,30].
L’elevato numero di fattori che influenzano la composizione e il contenuto fitochimico porta ad una gamma molto ampia di contenuto fenolico totale. Per i vini rossi, varia tra 1531 e 3192 mg di equivalenti di acido gallico (GAE) per litro, mentre era tra 210 e 402 per i vini bianchi [31].
Oltre ai composti fenolici, la melatonina è stata identificata anche nei vini e la sua presenza potrebbe essere responsabile del suo ruolo nei benefici per la salute del vino [32,33,34,35].
4.1. Modulazione delle vie biochimiche
Nel vino rosso, la quercetina rappresenta il principale flavanolo e la sua concentrazione è approssimativamente di 50 mg/L. Gli effetti benefici dei flavonoli alimentari sono stati correlati alle loro proprietà antiossidanti, all’attivazione di meccanismi antiossidanti endogeni e alla sovraregolazione dell’espressione dell’ossido nitrico sintasi (NOS). Inoltre, la quercetina ha dimostrato di contrastare e diminuire l’infiammazione; inibisce la traslocazione nucleare del fattore nucleare kappa-B (NF-kB) e riduce l’espressione dei recettori Toll-like (TLR2 e TLR4) [36].
In vivo, la maggior parte dei polifenoli sono scarsamente biodisponibili e in gran parte biotrasformati; per questi motivi sono stati sollevati dubbi sul fatto che le suddette attività antiossidanti e antinfiammatorie possano esercitare un ruolo primario negli effetti polifenolici in vivo; Tuttavia, possono modulare l’espressione genica e le cascate di segnalazione intracellulare coinvolte nella sopravvivenza e nella protezione cellulare. Infatti, in vivo, i polifenoli mostrano un debole, anche se efficace, effetto antiossidante diretto [37]. Da un punto di vista cinetico, non agiscono come spazzini dei radicali liberi, e considerando la loro scarsa biodisponibilità il loro contributo al sistema antiossidante cellulare è molto piccolo. Inoltre, i metaboliti e i composti parentali possono esercitare effetti biologici e l’identificazione di metaboliti sintetizzati dal microbiota amplia notevolmente l’elenco dei composti che possono esercitare un effetto biologico [38].
Anche se i polifenoli del vino in vivo non dovrebbero essere considerati antiossidanti diretti, potrebbero comportarsi come tali in alcune condizioni. Durante la digestione, nello stomaco, specialmente quando si consuma carne rossa, vengono prodotti perossidi lipidici fino alla concentrazione di mM [39,40]. Tale formazione di perossidi può essere prevenuta e ridotta dalla presenza di alimenti e bevande come l’olio extra vergine di oliva e il vino rosso che sono ricchi di polifenoli che si comportano come antiossidanti diretti e eliminano i perossidi lipidici.
Al giorno d’oggi, i componenti bioattivi del vino sono spesso definiti come “veicoli biomolecolari interattivi”, ovvero molecole in grado di proteggere l’organismo da una varietà di danni legati allo stress modulando le vie di segnalazione intercellulari che portano all’inibizione della sintesi di molecole pro-infiammatorie, alla formazione di ROS e al danno nucleare e inducendo l’espressione genica dell’enzima antiossidante. In particolare nel caso del resveratrolo, ma anche di altri polifenoli del vino e componenti bioattivi, questa induzione di geni antiossidanti comporta l’attivazione del fattore 2 (Nrf2) correlato al fattore nucleare eritroide 2 e delle sue vie a valle attraverso la xeno-ormesi. L’attivazione della via Nrf2 modula molteplici aspetti della difesa cellulare contro lo stress ossidativo, come la disintossicazione, il metabolismo cellulare e la regolazione della proliferazione cellulare, che sono cruciali nel meccanismo patologico di varie malattie [41].
È ora ampiamente riconosciuto e dimostrato che Nrf2 è cruciale nelle espressioni geniche mediate da ARE degli enzimi redox, inclusi antiossidanti e disintossicanti. Pertanto, la via Nrf2 è essenziale per prevenire quelle malattie la cui base fisiopatologica è rappresentata dallo stress ossidativo e dall’infiammazione [42,43]. Pertanto, il percorso Nrf2 può essere una potenziale opzione per prevenire le malattie croniche / degenerative.
I composti polifenolici tipicamente presenti nel vino rosso, come quercetina, catechina, epicatechina, procianidina B2, piceatannolo e silibinina, hanno dimostrato di contrastare lo stress ossidativo attivando la via Nrf2 e sovraregolando una serie di enzimi antiossidanti e proteine GSH, GST, GSTP1, NQO-1, HO-1 e SOD e metallotioneine 1 e 2 (MT-1/2) [44 ]. Inoltre, la via Nrf2/ARE regola l’espressione di oltre 500 geni tra cui enzimi di disintossicazione di fase I e II, subunità del proteasoma, chaperoni, fattori di crescita e altri fattori di trascrizione e proteine di trasporto [45].
Tra tutti i fitocomponenti presenti nel vino, il resveratrolo, appartenente alla famiglia degli stilbeni, è sicuramente il più studiato (per una rassegna completa vedi [46]).
Molti studi in vitro hanno dimostrato effetti biologici significativi e hanno evidenziato che il trans-resveratrolo (trans-3,5,4′-trihydoxystilbene, RES, Figura 2) modula vari bersagli correlati a diversi percorsi biochimici. L’interesse per il resveratrolo è stato, ed è tuttora, rivolto sia alla sua potenziale applicazione come agente terapeutico che come agente protettivo contro numerose malattie. Studi che utilizzano enzimi purificati e colture cellulari hanno suggerito che il resveratrolo ha proprietà antiossidanti, antinfiammatorie, anti-invecchiamento e anti-cancerogene che potrebbero essere rilevanti per la prevenzione / contrasto delle malattie croniche e / o la longevità nell’uomo [47,48].
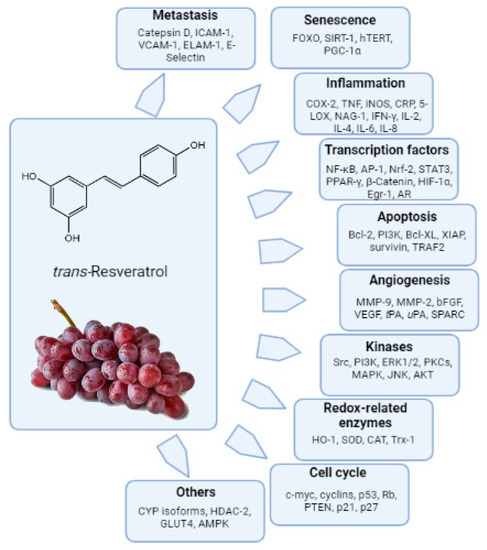
Figura 2. Bersagli biochimici modulati dal resveratrolo. AP-1, proteina attivatrice 1; CAT, catalasi; CDK, chinasi ciclina dipendente; COX, cicloossigenasi; CRP, proteina C-reattiva; CYP, citocromo P450; ER, recettore degli estrogeni; ERK, chinasi extra regolata cellulare; GPx, glutatione perossidasi; HIF, fattore che induce ipossia; hTERT, trascrittasi inversa della telomerasi umana; ICAM, molecola di adesione intracellulare; IAP, inibitore delle proteine dell’apoptosi; iNOS, ossido nitrico inducibile; MAPK, proteina chinasi attivata dai mitogeni; MMP, metalloproteinasi della matrice; NFκB, fattore nucleare kappa B; PI3K, fosfoinositide-3 chinasi; Rb, retinoblastoma; SOD, superossido dismutasi; STAT, trasduttore di segnale e attivatore di trascrizione; SPARC, proteina secreta acida e ricca di cisteina; TNF, fattore di necrosi tumorale; VEGF, fattore di crescita endoteliale vascolare.
Descrivere tutti i bersagli del resveratrolo biologicamente rilevanti è un compito molto complesso, reso più difficile dai risultati contrastanti ottenuti in sistemi diversi e dall’incertezza se gli effetti siano diretti o indiretti. Una discussione completa di questi problemi va oltre lo scopo di questa revisione ed è stata tentata da altri autori, ad esempio, [49,50].
Più recentemente, un dimero trans-resveratrolo chiamato trans-epsilon-viniferina (ε-viniferina), ha attirato l’interesse degli scienziati nel campo della salute umana [51]. La sua principale fonte alimentare è rappresentata dal vino rosso, e le concentrazioni più alte osservate sono state di circa 1 mg/L [52].
Negli ultimi quindici anni, molti studi hanno studiato gli effetti biologici della ε-viniferina e sono state descritte le sue proprietà antiossidanti e antinfiammatorie (per una revisione vedi [51]). In alcuni casi, le proprietà biologiche della ε-viniferina sono state segnalate per essere anche maggiori di quelle del resveratrolo stesso. Sono stati dimostrati i suoi effetti benefici in modelli sia in vivo che in vitro di tumori, obesità, disturbi legati all’obesità e malattie cardiovascolari o neurodegenerative. Inoltre, la ε-viniferina ha anche mostrato efficaci proprietà antimicrobiche [53].
Come con la maggior parte delle sostanze fitochimiche, incluso il resveratrolo, per essere in grado di definire chiaramente il suo potenziale impatto sulla salute, è essenziale definire il suo tasso di assorbimento e metabolismo [54]. Il tasso di assorbimento del resveratrolo è di circa il 75% (dose orale di 25 mg) [55], ma la biodisponibilità è scarsa [54]. Il resveratrolo viene rapidamente metabolizzato dagli enzimi metabolici di fase II e i suoi coniugati vengono rapidamente assorbiti attraverso il tratto gastrointestinale e diventano rilevabili nel siero 30-60 minuti dopo l’ingestione [56].
Il resveratrolo non può essere considerato l’unica cosa responsabile dei benefici associati al consumo moderato di vino rosso, piuttosto questi effetti sono attribuibili all’intero pool di antiossidanti presenti.
Tra i polifenoli, il resveratrolo è emerso come componente chiave nella regolazione dell’omeostasi vascolare. È stato dimostrato che interagisce con IR-1 e SIRT1, aumentando la capacità antiossidante, migliorando la salute metabolica e regolando la funzione endoteliale attraverso l’attivazione e la sovraregolazione di eNOS mentre inibisce le vie infiammatorie [57]. Inoltre, poiché il resveratrolo attiva SIRT1, potrebbe interferire con la fibrosi miocardica attraverso la via del fattore β (TGF-β) / Smad2 / 3 [58], eliminando la sintesi del collagene e la differenziazione dei fibroblasti cardiaci [59]. Il resveratrolo può proteggere dall’insufficienza cardiaca e dalla fibrosi cardiaca, indotta dall’ipertensione, inibendo la via di segnalazione PTEN / AKT / Smad2 / 3 e NF-kB, con conseguente protezione cardiaca. Ad esempio, inibisce il citocromo P450 (CYP) [60].
Inoltre, il resveratrolo può influenzare l’insorgenza e la progressione della fibrosi miocardica attivando la sirtuina 3 (SIRT3), regolando i livelli di gel di collagene di tipo I (COL1), gel di collagene di tipo III (COL3) e idrossiprolina (Hyp) e l’espressione di TGF-β, o regolando i livelli di SDF-1 e citochine immunitarie come TNF-α, malondialdeide (MDA) e IL-1 nello stress ossidativo [61 ]. In particolare, il resveratrolo migliora la fibrosi miocardica indotta da adriamicina aumentando la SIRT1 e diminuendo il fattore β1 (TGFβ1), che porta ad un aumento di glutatione (GSH) e SOD e ad una diminuzione di MDA, Hyp, TNF-α e creatina chinasi-MB (CK-MB).
Il resveratrolo agisce per migliorare la fibrosi miocardica indotta dalla miocardite virale diminuendo il propeptide carbossiterminale del procollagene di tipo I (PICP) e il propeptide amino-terminale del procollagene di tipo III (PIIINP) e aumentando il propeptide aminoterminale del pro-procollagene di tipo I (PINP).
Inoltre, il resveratrolo interferisce con altre citochine, come inibitore tissutale delle metalloproteinasi-2 (TIMP-2) e della metalloproteinasi della matrice (MMP-2), un importante enzima correlato al sistema MMP che regola il metabolismo della matrice miocardica, svolge un ruolo fondamentale nella degradazione della matrice e nella sintesi del collagene e media l’attivazione di diverse citochine, come TNF-α, TGF-β e IL-2 [1 ]. In particolare, il resveratrolo aumenta TIMP-62 e diminuisce MMP-2 e quindi regola il rapporto MMP-2 / TIMP-2, portando ad un miglioramento della fibrosi miocardica indotta da aterosclerosi. La riduzione coordinata di MMP-2, MMP-2 e del fattore di crescita dei fibroblasti 9 (FGF21) sostenuta dal resveratrolo provoca un avanzamento della fibrosi miocardica indotta dall’alcol.
Il resveratrolo regola anche i miRNA in I / R. È in grado di regolare la via di segnalazione della chinasi regolata dal segnale extracellulare (ERK), della proteina attivata da mitogeni (MAP) nei fibroblasti cardiaci attraverso miR-21, miR-20b, miR-27a e miR-9 [63]. Il decremento coordinato sostenuto dal resveratrolo delle vie diacilglicerolo (DAG)/protein chinasi A (PKA) e ROS/ERK/TGFβ1 che porta ad una riduzione della periostina si traduce in un miglioramento della fibrosi miocardica indotta dal diabete.
4.2. Assunzione di vino ed espressione genica
Il vino, essendo una soluzione idroalcolica, fornisce un po ‘di alcol alla dieta e l’alcol, anche a basso consumo, può esercitare effetti dannosi sulla salute.
Tra gli altri, il suo consumo cronico è direttamente correlato a numerose malattie non trasmissibili, come la cirrosi epatica e i tumori. L’alcol è classificato, dalla IARC, all’interno del Gruppo 1 degli agenti cancerogeni; È causalmente associato allo sviluppo di tumori del tratto digestivo superiore e del fegato e può essere positivamente associato al colon-retto e al cancro al seno femminile con prove sufficienti. Durante il suo metabolismo, l’alcol viene ossidato in acetaldeide. L’acetaldeide è una sostanza reattiva e potrebbe mediare la maggior parte della tossicità indotta dall’etanolo che porta allo sviluppo di malattie croniche, come malattie epatiche e cardiovascolari e cancro [64]. Chimicamente, l’acetaldeide mostra un comportamento elettrofilo; può interagire direttamente con proteine, lipidi e DNA per formare coniugati covalenti [65].
Questi coniugati possono influenzare l’omeostasi cellulare e la sopravvivenza attraverso l’alterazione della struttura proteica e/o il danno al DNA. Le aldeidi deidrogenasi (ALDH) rappresentano una superfamiglia enzimatica composta da 19 membri che svolgono un ruolo chiave nel metabolismo delle aldeidi catalizzando l’ossidazione dell’aldeide. Nella famiglia ALDH, ALDH classe-2 (ALDH2) è un isoenzima mitocondriale ed è espresso principalmente nel fegato. Svolge un ruolo importante nell’ossidazione dell’acetaldeide in acido acetico non tossico [66].
Due metaboliti della quercetina, vale a dire l’acido 3-idrossifenilacetico (OPAC) e l’acido 3,4-diidrossifenilacetico (DOPAC), hanno dimostrato di indurre enzimi metabolici farmacologici. Inoltre, l’OPAC ha mostrato attività di potenziamento dell’ALDH in un modello di epatociti in coltura [67]; in questo studio l’OPAC ha potenziato l’attività totale di ALDH sovraregolando la trascrizione genica attraverso la via dipendente dal recettore degli idrocarburi arilici (AhR). Grazie alle sue proprietà biologiche uniche, l’OPAC può potenziare il metabolismo dell’acetaldeide da parte degli ALDH e contribuire anche alla protezione dal danno epatico indotto dall’alcol dopo il consumo di diete ricche di quercetina.
Se l’OPAC appare come il metabolita più efficace nel promuovere la disintossicazione da acetaldeide attraverso gli ALDH, altri composti bioattivi nutraceutici potrebbero contribuire a una strategia protettiva volta a mantenere bassi i livelli di acetaldeide. È stato dimostrato che il resveratrolo e i flavonoidi del vino rosso modulano l’espressione della gamma-glutamilcisteina sintetasi, l’enzima limitante la velocità nella sintesi del glutatione (GSH), il più importante antiossidante cellulare endogeno coinvolto sia nelle difese antiossidanti cellulari che nella disintossicazione xenobiotica [68]. Il GSH partecipa direttamente alla disintossicazione da acetaldeide e i livelli di GSH diminuiscono in presenza di acetaldeide [69].
Lo stress ossidativo, l’infiammazione, i profili lipidici e dei carboidrati e il metabolismo dei farmaci possono influenzare l’espressione genica. Diversi studi dimostrano che le bevande e gli alimenti caratterizzati da un significativo effetto antiossidante contengono sostanze in grado di prevenire danni al sistema cellulare dovuti ai ROS. Uno dei meccanismi biochimici responsabili del processo di invecchiamento è la progressiva perdita della perfetta replicazione del DNA nelle cellule figlie. Dopo diversi processi di replicazione, queste alterazioni si accumulano nella trascrizione del DNA cellulare e attivano sequenze geniche che possono causare degenerazione e morte a lungo termine. Alcuni nutraceutici potrebbero ridurre questi errori di replicazione modulando i relativi processi infiammatori e contrastando l’effetto ROS. I ROS, che aumentano nello stato postprandiale, sono stati segnalati per essere in grado di danneggiare le strutture cellulari e attivare alcuni fattori di trascrizione coinvolti nell’attivazione dell’espressione genica correlata a immunità, infiammazione, proliferazione cellulare, crescita e apoptosi [70,71]. In questo modo, i ROS accelerano l’invecchiamento e portano a malattie cardiovascolari, neurodegenerative e oncologiche [72]. Inoltre, sono responsabili dell’ossidazione delle LDL-C (Ox-LDL), che si accumulano nella tunica intima, dove vengono ingerite dai macrofagi [73].
L’infiammazione indotta dallo stress ossidativo e Ox-LDL sulle cellule vascolari, aumentando l’adesione di monociti e macrofagi, porta alla formazione e all’infiltrazione di cellule schiumogene cariche di colesterolo nella parete del vaso, portando allo sviluppo del processo aterosclerotico [73,74].
I polifenoli presenti nel vino rosso, come acidi fenolici, stilbeni, tannini e flavonoidi, come catechina, quercetina e antociani, possono potenziare il sistema antiossidante endogeno dei consumatori [75].A seguito dell’assunzione di vino rosso, vengono attivati i sistemi di difesa antiossidante endogena [76], come le attività della superossido dismutasi (SOD), della catalasi (CAT) e della glutatione perossidasi (GPx) [77,78]. La riduzione dei livelli di ROS circolanti, e di conseguenza del processo di ossidazione delle LDL [79], dipende dai livelli di espressione di SOD e GPx. Infatti, SOD può convertire l’anione superossido (O-) in perossido di idrogeno (H2O2), riducendo i livelli di O e il danno al DNA mitocondriale [80]; H2O2 sarà trasformato in acqua da GPX1 o CAT [78]. CAT, SOD e GPX aumentano la loro espressione attraverso l’integrazione alimentare di resveratrolo e quercetina [81].
La dieta mediterranea, ricca di verdure, legumi, frutta e noci, cereali, pesce, olio d’oliva e una moderata quantità di vino durante i pasti, con minori quantità di carne e latticini, è raccomandata come modello alimentare sano. Oltre al vino, nel MedDiet componenti bioattivi provenienti da altri alimenti, come polifenoli e fitosteroli da olio d’oliva (idrossitirosolo, tirosolo, oleocantale), noci, frutta e verdura (flavonoidi, principalmente), possono contribuire ad aumentare gli effetti protettivi attraverso meccanismi sinergici.
Alcuni benefici del consumo di vino legato alla dieta mediterranea possono essere correlati al modello di consumo piuttosto che semplicemente alla quantità di alcol consumato. Il modello mediterraneo di consumo di alcol, il cosiddetto “modo mediterraneo di bere” che significa un moderato apporto di vino principalmente durante i pasti [2], potrebbe rappresentare il modo migliore per diminuire gli effetti tossici dell’etanolo e contemporaneamente aumentare le difese antiossidanti/disintossicanti grazie all’effetto sinergico di una vasta gamma di componenti bioattivi in grado di modulare le difese dell’organismo e proteggere dalle malattie croniche/degenerative.
Di Renzo et al. [79] hanno evidenziato l’effetto dell’assunzione combinata di vino rosso (RW) o bianco (WW) o vodka (VDK) con un pasto mediterraneo (MeDM) o un pasto ad alto contenuto di grassi (HFM) in uno studio clinico condotto su 54 volontari sani. Hanno esaminato l’Ox-LDL e valutato l’espressione genica di geni selezionati appartenenti alla via dello stress infiammatorio e ossidativo, come CAT, SOD2 e GPX1. Pertanto, è stato eseguito uno studio clinico randomizzato controllato su volontari sani in stato di digiuno o tempo postprandiale, dopo un pasto mediterraneo o ricco di grassi, con o senza assunzione di bevande alcoliche. In particolare, hanno osservato una significativa sovraregolazione della CAT solo dopo RW. Al contrario, la somministrazione di WW e VDK ha determinato una significativa downregulation dell’espressione genica CAT e la combinazione di HFM con WW e VDK, mostrando un possibile decremento a valle dell’espressione genica dell’enzima antiossidante causato da bevande con concentrazioni polifenoliche basse o nulle. L’espressione del gene SOD2 è stata sovraregolata nel trattamento WW, MeDM + VDK e soprattutto nella somministrazione di RW, dimostrando una maggiore sensibilità di questo gene ad alto e basso contenuto polifenolico. D’altra parte, il trattamento HFM + VDK ha determinato una downregulation della sua espressione.
Inoltre, è stato dimostrato che i polifenoli del vino rosso possono anche regolare l’infiammazione, riducendo il rischio di malattie correlate [36]. L’infiammazione è un complesso processo biologico caratterizzato dalla regolazione coordinata di diversi insiemi di geni, come la chemochina C-C motivo ligando 5 (CCL5). CCL5 è una citochina chemiotattica, generalmente chiamata RANTES (regolata all’attivazione, normale espressione delle cellule T e secreta), che svolge diversi ruoli nella malattia infiammatoria [82]. Inoltre, nell’uomo, sono stati identificati sette tipi di sirtuine, regolatori dell’informazione silenziosa (SIR), [83]. Le sirtuine sono una classe di proteine con attività deacetilasi o monoribosiltransferasi, che regolano la deacetilasi NAD+-dipendente su diversi processi biologici come la durata della vita, l’invecchiamento, la neurodegenerazione, la tumorigenesi e le malattie metaboliche. Sebbene la sua funzione e il suo meccanismo biologico non siano del tutto compresi, la proteina citoplasmatica SIRT2 della sirtuina ha dimostrato di aumentare in risposta allo stress ossidativo. Tuttavia, promuove la morte cellulare attraverso le proteine Forkhead Box (FOXO) [84].
Di Renzo et al. [85] hanno evidenziato gli effetti dell’assunzione combinata di vino rosso con pasti diversi in uno studio clinico. In particolare, hanno scoperto che i livelli di Ox-LDL sono diminuiti significativamente dopo un pasto mediterraneo (MM) rispetto a un pasto McDonald’s (McD) o dopo un pasto mediterraneo con 250 ml di vino rosso (MMRW) rispetto al digiuno con vino rosso (FRW), o dopo un pasto McDonald’s con vino rosso confrontato (McDRW) con McD, indicando che il potenziale antiossidante dei composti bioattivi presenti nel vino rosso e nella dieta mediterranea può essere una componente essenziale di un approccio olistico per combattere l’ossidazione delle LDL.
Inoltre, hanno analizzato la variazione dell’espressione genica di cinque geni legati allo stress ossidativo e all’infiammazione a seconda del consumo di pasti diversi con e senza vino rosso.
Hanno osservato che l’espressione di CAT è diminuita significativamente dopo McD. Al contrario, è stato osservato un aumento significativo dell’espressione di CAT nella FRW rispetto al basale (B) e nella McDRW rispetto a quelle senza vino. Allo stesso tempo, l’espressione di GPX1 è aumentata significativamente in FRW, McDRW e MMRW rispetto a B. Non è stata osservata alcuna espressione significativa di SOD in tutte le condizioni. L’espressione di CCL5 è aumentata significativamente nel confronto tra McD, MM ed entrambi i pasti con vino rispetto a B, e in FRW rispetto a McDRW. Nel frattempo, l’espressione di CCL5 è diminuita significativamente tra MM rispetto a quelli con vino rosso.
Anche l’espressione di SIRT2 è aumentata significativamente rispetto a FRW rispetto a MMRW. Inoltre, dopo McD con e senza consumo di vino, SIRT2 è espresso in misura minore rispetto a dopo MM, dimostrando che SIRT2 è sovraregolato in risposta allo stress ossidativo e alla restrizione calorica e promuove la morte cellulare in condizioni di grave stress attraverso l’interazione con FOXO3a [86]. Inoltre, dopo un MMRW, sembra che una maggiore espressione di SIRT2 fosse negativamente correlata con l’espressione di CCL5, confermando un effetto protettivo del PEP-1-SIRT2 trasdotto contro l’infiammazione e lo stress ossidativo. È stata anche osservata una correlazione positiva tra SIRT2 e CAT, che potrebbe essere dovuta all’aumento dell’espressione di CAT da parte di SIRT2, confermando che la modulazione di SIRT2 attraverso la dieta può avere un impatto significativo sull’infiammazione [87].
Diversi studi hanno dimostrato che molti dei polifenoli presenti nel vino rosso possono avere diversi effetti fisiologici attivando vie di segnalazione chiave come il recettore dell’insulina 1 (IR-1) e la sirtuina 1 (SIRT1), che sono coinvolti nella sensibilità all’insulina, nella regolazione cellulare e nei processi infiammatori [88].
5. Vino e salute: dati epidemiologici
La correlazione tra consumo di vino e salute è stata oggetto di un dibattito di lunga data. Il consumo da basso a moderato di vino ha dimostrato di essere associato a vari vantaggi per la salute sia nelle popolazioni maschili che femminili. Come discusso in precedenza, gli effetti benefici del vino derivano principalmente dal suo contenuto polifenolico [59] e questo rappresenta la differenza cruciale tra vino e altre bevande alcoliche. Infatti, il vino rosso contiene in media 1,8 g/L di polifenoli, e il loro contenuto nel vino bianco varia tra 0,2 e 0,3 g/L [89,90,91], mentre il loro contenuto nella birra è in media di 28 mg/100 ml e gli alcolici difficilmente non ne contengono. L’obiettivo principale di questa revisione narrativa era quello di considerare la correlazione tra consumo di vino da basso a moderato e salute.
5.1. Consumo di vino da basso a moderato e malattie cardiovascolari
Questa ricerca è stata condotta con le parole chiave: “alcol” E “vino” E “malattie cardiovascolari (CVD)” E “cardiopatia ischemica (IHD)”. Abbiamo analizzato un totale di otto studi: sei studi prospettici basati sulla popolazione, uno studio prospettico multicentrico in aperto e una meta-analisi. La descrizione degli studi è presentata nella tabella 1.In tutti gli otto studi selezionati è stata osservata una riduzione del rischio di malattie cardiovascolari, e in particolare di IHD, in soggetti con consumo moderato di alcol rispetto agli astemi [92,93,94,95,96,97] (Tabella 1). In particolare, tre studi hanno evidenziato il ruolo benefico del vino nella prevenzione delle malattie cardiovascolari (CVD) [95,98,99] e uno ha dimostrato che tra i bevitori moderati di alcol c’è un vantaggio per i bevitori di vino rispetto ai non bevitori di vino [95].
È stato anche dimostrato che i bevitori di vino bassi (1-7 drink / settimana) e moderati (8-21 drink / settimana) hanno rispettivamente il 20% e il 24% in meno di mortalità per tutte le cause rispetto ai non bevitori di vino [98]. Inoltre, rispetto agli astemi, i bevitori di alcol con un’assunzione da 5 a 15 g al giorno erano associati a un rischio inferiore del 26% di malattie cardiovascolari, al 35% in meno di rischio di mortalità totale e al 51% in meno di rischio di mortalità per malattie cardiovascolari, se il consumo di alcol era principalmente vino rosso [102]. Vari meccanismi biochimici sono coinvolti nell’effetto cardioprotettivo del consumo moderato di vino rosso [103]; Tuttavia, il dibattito sui reali effetti cardioprotettivi del consumo moderato di vino è ancora acceso oggi [104]. Ovviamente, per quanto riguarda la prevenzione delle malattie cardiovascolari, gli astemi non dovrebbero iniziare a bere alcolici per ridurre il rischio di CVD, ma l’evidenza epidemiologica indica che non c’è motivo di suggerire a coloro che bevono vino con moderazione di smettere di berlo.
Tabella 1. Studi sul consumo di vino e sul rischio di malattie cardiovascolari.
5.2. Consumo di vino da basso a moderato e diabete di tipo 2
Questa ricerca è stata condotta con le parole chiave: “alcol” E “vino” E “diabete di tipo 2”. Abbiamo analizzato un totale di tre studi: uno studio prospettico basato sulla popolazione, uno studio caso-controllo e una meta-analisi. La descrizione degli studi è presentata nella tabella 2.Diversi studi hanno studiato il consumo di vino rosso e i suoi effetti sui livelli di glucosio e sul diabete di tipo 2 (T2D). Due degli studi selezionati hanno dimostrato che i bevitori regolari di vino rosso hanno livelli di glucosio più bassi [105] e una minore incidenza di diabete rispetto agli astemi [106] (Tabella 2). Inoltre, è noto che il consumo di vino rosso riduce l’insulina plasmatica e la valutazione del modello di omeostasi della resistenza all’insulina [107]. Le donne con consumo regolare di vino rosso sono risultate avere il rischio più basso di diverse malattie come il tipo T2D [108]. Il terzo studio selezionato, condotto su pazienti con T2D, ha mostrato che coloro che hanno riportato un consumo moderato di alcol, principalmente di vino, hanno avuto meno eventi cardiovascolari e una minore mortalità per tutte le cause [109] (Tabella 2). Inoltre, 150 ml / giorno di assunzione di vino rosso per due anni hanno aumentato significativamente i livelli di HDL-C e Apo AI e diminuito il rapporto colesterolo totale (TC) / HDL nei pazienti con T2D [110]. In conclusione, il vino rosso è protettivo contro il T2D ed è associato a una migliore sensibilità all’insulina.Tabella 2. Studi sul consumo di vino e sul diabete di tipo 2.
5.3. Consumo di vino da basso a moderato e malattie neurodegenerative
Questa ricerca è stata condotta con le parole chiave: “alcol” E “vino” E “malattie neurodegenerative”. Abbiamo analizzato un totale di tre studi: due studi prospettici basati sulla popolazione e una meta-analisi. La descrizione degli studi è presentata nella tabella 3.L’abuso cronico di alcol provoca una significativa attivazione dei processi neurodegenerativi [111], ma tre dei quattro studi selezionati riportati nella Tabella 3 mostrano che il rischio di sviluppare malattie neurodegenerative è ridotto nei soggetti adulti con consumo moderato di bevande alcoliche, in particolare di vino [112,113,114]. La demenza e la depressione possono essere ridotte bevendo vino moderatamente [112]. È stato suggerito che il consumo di alcol da basso a moderato potrebbe essere benefico per la salute dei soggetti di mezza età [115] e anziani [116,117], portando a un’associazione a forma di J o a forma di U inversa tra alcol e funzione cognitiva [118]. I rischi relativi di sviluppare ictus ischemico e malattia di Alzheimer o demenza vascolare sono anche ridotti dal consumo moderato di alcol [119]. Un quarto studio selezionato [120] ha riportato una relazione a forma di J tra assunzione di alcol e declino cognitivo in pazienti con decadimento cognitivo lieve. Questo studio ha dimostrato che l’elevato consumo di bevande alcoliche, così come la completa astensione, aumenta il rischio di demenza, mentre il consumo di alcol leggero-moderato può essere associato a un ridotto rischio di demenza [120]. In particolare lo studio ha riportato che, negli adulti, bere vino da leggero a moderato e regolare ha un effetto protettivo contro la demenza [120]. Questi risultati sono confermati dalla revisione di Collins et al. [121]. Uno studio recente conferma i dati precedenti che mostrano un effetto protettivo del consumo di vino contro il declino cognitivo: il RR aggregato per l’effetto del consumo di vino sul declino cognitivo era 0,72 [113]. Nel 1998, il Copenhagen City Heart Study ha trovato una relazione a forma di U tra l’assunzione di alcol e il rischio di ictus. L’assunzione di vino su base mensile, settimanale o giornaliera è stata associata a un minor rischio di ictus rispetto a nessuna assunzione di vino (mensile: rischio relativo [RR], 0,83; settimanale: RR, 0,59; giornaliero: RR, 0,70). Al contrario, non vi era alcuna associazione tra l’assunzione di birra o alcolici sul rischio di ictus [114] (Tabella 3).Tabella 3. Studi sul consumo di vino e sul rischio di malattie neurodegenerative.
5.4. Consumo di vino da basso a moderato e cancro
Questa ricerca è stata condotta con le parole chiave: “alcol” E “vino” E “cancro”. Abbiamo analizzato un totale di cinque studi: uno studio prospettico multicentrico basato sulla popolazione, tre studi prospettici di coorte e uno studio caso-controllo. La descrizione degli studi è presentata nella tabella 4.
C’è un forte consenso scientifico sul fatto che il consumo di alcol può causare un aumento correlato alla dose del rischio di cancro [122]. Sono emersi modelli chiari tra il consumo di alcol e lo sviluppo del cancro della testa e del collo, dell’esofago, del fegato, del seno, del colon e del retto [122]. Di conseguenza, molte istituzioni e autorità forniscono linee guida e raccomandazioni sul consumo di alcol. Le conclusioni del terzo rapporto di esperti “Dieta, nutrizione, attività fisica e cancro: una prospettiva globale” prodotto nel 2018 dal World Cancer Research Fund International per conto del World Cancer Research [123] indicano che: “per la prevenzione del cancro, è meglio non bere alcolici. Se consumi bevande alcoliche, non superare le linee guida nazionali“. Le linee guida su alcol e salute pubblica dei Centers for Disease Control and Prevention (CDC) degli Stati Uniti d’America [124] indicano che: “Le linee guida dietetiche per gli americani raccomandano che gli adulti in età legale per bere possano scegliere di non bere o di bere con moderazione limitando l’assunzione a 2 drink o meno in un giorno per gli uomini o 1 drink o meno in un giorno per le donne“. Il recente articolo di Clinton et al. [125] indica che: “1. Il consumo di bevande alcoliche è una causa di diversi tumori. 2. Per la prevenzione del cancro, è meglio non bere alcolici. 3. L’evidenza di un aumento del rischio di cancro è per l’assunzione di alcol >30 g / giorno“. Conclusioni simili sono state riportate nel codice europeo contro il cancro [126], che afferma nella sua 4a edizione pubblicata nel 2016: “Non bere alcolici è meglio per la prevenzione del cancro. Se bevi alcolici di qualsiasi tipo, limita l’assunzione” [127].
Il resveratrolo, che si trova nell’uva e nel vino (principalmente vino rosso), è stato studiato per molti possibili effetti sulla salute, compresa la prevenzione del cancro [128]. Se l’assunzione moderata di vino rosso possa proteggere dal cancro è ancora controversa [129]. I suddetti benefici per la salute del resveratrolo contro il cancro prodotto in ambiente di laboratorio non possono essere tradotti in effetti sulla popolazione a vita libera. Infatti, tre studi di coorte (condotti in paesi non mediterranei) sui tumori del polmone, del colon-retto e della prostata e uno studio sulla mortalità complessiva per cancro (condotto in un paese mediterraneo) hanno riportato che il consumo moderato di alcol / vino non contribuisce in modo apprezzabile all’eziologia o alla protezione di tali tumori maligni (Tabella 4) [130,131,132,133].
La dieta mediterranea tradizionale che include un consumo moderato di vino durante la vita adulta è associata a un ridotto rischio di cancro. Questo modello di bere non influenza sensibilmente il rischio complessivo di cancro [134]. L’unico problema critico sembra essere il rischio di cancro al seno, ma uno studio recente ha mostrato una forte associazione tra aderenza alla dieta mediterranea e riduzione del rischio di cancro al seno con un odds ratio di 0,82 [135] (Tabella 4). È interessante notare che l’esclusione della componente etanolo (principalmente dovuta al vino) dal punteggio della dieta mediterranea non ha modificato materialmente i risultati (OR = 0,81).Tuttavia, come detto in precedenza, il consumo di alcol pesante è associato a tumori digestivi, del tratto respiratorio superiore, del fegato e della mammella; Pertanto, la limitazione del consumo di alcol è un obiettivo prioritario e le autorità nazionali e internazionali dovrebbero suggerire che il consumo di alcol dovrebbe essere evitato per prevenire il cancro e quando l’alcol viene consumato la quantità dovrebbe essere limitata a due drink / giorno negli uomini e un drink / giorno nelle donne.Table 4. Studies that considered wine and cancer risk.

5.5. Consumo di vino da basso a moderato e longevità
Questa ricerca è stata condotta con le parole chiave: “alcol” E “vino” E “longevità”. Abbiamo analizzato un totale di quattro studi: due studi prospettici basati sulla popolazione, uno studio longitudinale e una meta-analisi. La descrizione degli studi è presentata nella tabella 5.
In tutti e quattro gli studi selezionati la relazione tra consumo di alcol e mortalità è una curva a forma di J che mostra che il consumo moderato di alcol riduce la mortalità rispetto all’assenza di consumo di alcol [93,96,136,137] (Tabella 5). Questi benefici sono osservati a dosi di circa 3-30 g / die di alcol nelle donne e 12-60 g / die negli uomini. Un effetto protettivo massimo si trova a una media di 20 g di assunzione di alcol puro al giorno. Gli effetti benefici dell’assunzione moderata di alcol sono maggiori della completa astinenza, ma si perdono quando il consumo è eccessivo [102]. Il Copenhagen Prospective Population Study ha dimostrato che l’assunzione di vino può avere un effetto benefico sulla mortalità per tutte le cause che è additivo rispetto al solo alcol [138] (Tabella 5).Vari studi hanno dimostrato che il resveratrolo può prolungare la durata della vita [139]. In effetti, il resveratrolo potrebbe aumentare la longevità in molti modelli animali, principalmente inducendo l’autofagia Sirt1-dipendente, riducendo lo stress ossidativo e la neuroprotezione [140], ma sono necessarie ulteriori ricerche sugli esseri umani prima di trarre conclusioni finali sulla correlazione tra resveratrolo e longevità.Tabella 5. Studi sul consumo di vino e sulla longevità.

6. Il modo mediterraneo di bere: vino con moderazione
Le diete a base vegetale, definite in termini di consumo da basso a moderato di alimenti di origine animale, offrono una vasta gamma di benefici per la salute, tra cui l’aiuto nella prevenzione e nella gestione di varie malattie come malattie cardiovascolari, diabete, obesità e cancro [141]. La dieta mediterranea, una dieta a base vegetale e uno dei modelli dietetici più sani e studiati, include due alimenti fluidi nelle sue linee guida nutrizionali: l’olio d’oliva, come principale fonte di grassi, e un consumo da basso a moderato di vino [142]. I meccanismi che guidano gli effetti benefici della dieta mediterranea includono la riduzione dei marcatori di infiammazione e stress ossidativo, il miglioramento del profilo lipidico, la sensibilità all’insulina e la funzione endoteliale e le proprietà antitrombotiche. La maggior parte di questi effetti sono attribuibili a ingredienti bioattivi, tra cui fibre, polifenoli e acidi grassi mono e polinsaturi [142]. Il consumo moderato di vino fa parte della dieta mediterranea, insieme a un “modo mediterraneo di bere”, cioè un consumo regolare e moderato di vino in età adulta, principalmente con il cibo (fino a due bicchieri al giorno per gli uomini e un bicchiere per le donne) [2]. Il vino è quindi considerato una bevanda distintiva della dieta mediterranea che contribuisce ai suoi benefici per la salute, con alcuni dei percorsi biologici suggeriti che coincidono con quelli della dieta mediterranea [143].
Lo stile di consumo mediterraneo proposto [2] consiste in un limite raccomandato di consumo di alcol che non dovrebbe superare i 30 g di etanolo (cioè circa due bicchieri di vino al giorno, in combinazione con i pasti) per gli uomini e 15 g (un bicchiere) per le donne. Tuttavia, la definizione di consumo moderato di alcol può variare da paese a paese. Gli Stati Uniti, ad esempio, considerano il consumo moderato di alcol da parte degli adulti in età legale per bere una quantità giornaliera di 10 g di etanolo (1 bevanda) per le donne e 20 g di etanolo (2 bevande) per gli uomini. Tuttavia, altre linee guida considerano il consumo giornaliero di 10 g a 42 g di alcol (da 1 a 3 drink) per le donne o da 10 g a 56 g per gli uomini (da 1 a 4 drink) come un modello a basso rischio [36].
7. L’impatto del consumo di alcol sulla salute umana
L’etanolo è una sostanza tossica e psicoattiva con proprietà di dipendenza a causa di una combinazione di predisposizione genetica e danni cerebrali dal consumo di alcol. Circa il 4% degli adulti soffre di dipendenza da alcol, una sindrome comportamentale complessa che comporta l’incapacità di controllare il consumo di alcol nonostante le note conseguenze negative sociali, occupazionali e sanitarie. Il consumo di alcol è associato a rischi per la salute, anche se questi rischi variano significativamente in termini di entità e conseguenze sulla salute tra i bevitori, a seconda del volume di alcol consumato nel tempo, del tipo di bevanda alcolica, del modello di consumo e della dieta.
Inoltre, Stockwell et al. riferiscono che le stime del rischio di mortalità da alcol sono significativamente alterate dal disegno e dalle caratteristiche dello studio. Le meta-analisi che aggiustano per questi fattori rilevano che il consumo di alcol a basso volume non ha alcun beneficio netto di mortalità rispetto all’astensione a vita o al consumo occasionale [144]. Inoltre, gli autori dell’indagine di una grande coorte dell’indagine prospettica europea sul cancro hanno concluso che vari pregiudizi potrebbero influenzare i risultati degli studi osservazionali sul beneficio per la salute dell’uso di alcol da basso a moderato [145].
Un’attenzione particolare deve essere rivolta ai giovani. L’analisi Global Burden of Disease stima che, per i giovani adulti di età compresa tra 15 e 39 anni, il consumo di alcol non ha benefici per la salute, ma solo rischi [146,147]. L’alcol è infatti il principale fattore di rischio per la mortalità prematura e la disabilità tra le persone di età compresa tra 15 e 49 anni, rappresentando il 10% di tutti i decessi in questa fascia di età [148]. Per gli adolescenti e i giovani adulti, l’alcol è la sostanza psicotropa più utilizzata e costituisce un grave problema di salute. Il carico di malattia, i costi sociali e i danni associati al suo uso sono estesi e comuni nei giovani adulti. Inoltre, lo sviluppo di successivi danni correlati all’alcol è stato collegato all’inizio precoce del consumo di alcol durante l’adolescenza [149]. Il consumo di alcol da parte dei minorenni è associato a una vasta gamma di conseguenze negative per gli adolescenti, tra cui effetti negativi sul normale sviluppo del cervello e sul funzionamento cognitivo, comportamenti sessuali a rischio, aggressioni fisiche e sessuali, lesioni, blackout, overdose di alcol e persino la morte. Rispetto all’uso da parte degli adulti, l’uso di alcol da parte degli adolescenti è molto più probabile che sia episodico e in volumi maggiori (binge drinking), il che rende l’uso di alcol da parte di coloro che appartengono a questa fascia di età particolarmente pericoloso [150].
Sebbene il consumo eccessivo di alcol sia un grave problema di salute pubblica in tutto il mondo a causa della sua elevata prevalenza e delle sue conseguenze sanitarie e sociali, l’assunzione moderata, specialmente durante i pasti, potrebbe essere un modello a basso rischio, ma solo per le persone di età superiore ai 40 anni, come indicato da GBD 2020. Per le persone in questa fascia di età, l’assunzione moderata di alcol può fornire alcuni benefici per la salute, come un ridotto rischio di malattie cardiovascolari, ictus e diabete, ma anche un possibile aumento del rischio di altre malattie [146,147].
L’etanolo è in realtà teratogeno, genotossico e cancerogeno, epatotossico, neurotossico per il cervello, provoca lesioni e aumenta il rischio di malattie cardiovascolari e altre malattie non trasmissibili (cioè HIV, tubercolosi, polmonite e infezione da COVID-19) [151].
Da qui la necessità di programmi educativi sul consumo consapevole rivolti soprattutto ai giovani per evitare l’eccesso e l’abuso di alcol.
8. Conclusioni
Il vino è in realtà un’alchimia dalle proprietà uniche, con una composizione ricca e originale in termini di polifenoli e antiossidanti e un’associazione protettiva tra consumo di vino da basso a moderato e malattie cardiovascolari, diabete di tipo 2 e disturbi neurologici [152]. Vi è quindi una forte evidenza scientifica dai paesi mediterranei e non mediterranei che il consumo moderato di vino aumenta la longevità, riduce il rischio di malattie cardiovascolari e non influenza sensibilmente il rischio complessivo di cancro [134] anche se va sottolineato che non bere alcolici è meglio per la prevenzione del cancro [126].
La gradazione alcolica varia tra i diversi tipi di vino, oscillando intorno al 14% per il vino rosso e all’11% per il vino bianco, che è molto inferiore a quello dei distillati (circa il 35%). Il vino rosso ha un’alta concentrazione di composti polifenolici; Il contenuto nel vino bianco è inferiore, mentre è praticamente trascurabile nelle bevande distillate (alcolici e liquori) [152]. Oltre ai polifenoli, ci possono essere anche altri componenti bioattivi fenolici e non fenolici nel vino, di solito meno considerati, che possono contribuire ai presunti effetti sulla salute.
I componenti bioattivi non sono l’unica ragione degli effetti benefici associati al consumo di vino; Anche i fattori sociali contano. La dieta mediterranea è un modello alimentare che è anche considerato sano perché suggerisce di consumare vino durante i pasti [2]. Se consumato durante i pasti, il vino tende ad essere sorseggiato più lentamente rispetto ad altre bevande alcoliche e questo può fornire benefici metabolici. Inoltre, la presenza concomitante di cibo nello stomaco rallenta l’assorbimento dell’etanolo, favorendo il metabolismo e la clearance epatica e abbassando la concentrazione di picco di alcol nel sangue. La presenza concomitante di cibo può anche ridurre la quantità di alcol disponibile per il microbiota orale, che ha la capacità di metabolizzare l’etanolo in acetaldeide, un composto associato agli effetti tumorali dell’etanolo nel tratto gastrointestinale superiore. Inoltre, la presenza di alcol può migliorare la biodisponibilità dei polifenoli nel bolo alimentare, rendendoli più assimilabili [153] e può ridurre la bioaccessibilità al glucosio, che è coerente con gli effetti ipoglicemici osservati negli studi di intervento e osservazionali sul consumo moderato di vino.
Questa revisione narrativa ha limitazioni basate sulla selezione della letteratura, con un numero limitato di articoli valutati, e sul tipo di analisi dei dati. Ulteriori e future ricerche con nuove meta-analisi dei dati esistenti, nonché nuovi studi controllati e studi prospettici devono essere pianificati al fine di analizzare con maggiore precisione i dati esistenti, produrre nuove prove su questo argomento dibattuto e concentrarsi più chiaramente sugli effetti differenziali del vino rispetto ad altre bevande alcoliche. Sono necessarie revisioni sistematiche per superare i rischi di parzialità di questo articolo e per definire più chiaramente i dati negativi e nulli della letteratura. In particolare, questo documento può mostrare distorsioni nella selezione dei documenti e nella segnalazione dei risultati.
Questa revisione narrativa è stata scritta per servire governi, organizzazioni, industria, operatori sanitari e individui in una varietà di capacità con l’obiettivo di migliorare la salute e ridurre il carico globale di varie malattie, tra cui malattie cardiovascolari, diabete di tipo 2 e malattie neurodegenerative, e per favorire la longevità, ma anche per ricordare fortemente gli effetti negativi della dipendenza da alcol.
In conclusione, il vino si differenzia dalle altre bevande alcoliche e il suo consumo moderato non solo non aumenta il rischio di malattie cronico-degenerative ma è anche associato a benefici per la salute. Tuttavia, gli operatori sanitari non dovrebbero raccomandare l’alcol ai non bevitori a causa della scarsità di dati di esito randomizzati e del potenziale di consumo problematico anche tra individui apparentemente a basso rischio, e ogni sforzo deve essere fatto per promuovere l’educazione comportamentale per prevenire gli abusi, specialmente tra i giovani. Inoltre, sono necessarie ulteriori ricerche per valutare e chiarire i dubbi ancora esistenti.
Contributi dell’autore
Concettualizzazione S.H. e A.G.; scrittura – preparazione della bozza originale S.H., L.D.R., L.B., E.B. e A.G.; scrittura—revisione e revisione, S.H., M.M. e A.G.; supervisione, S.H. e A.G. Tutti gli autori hanno letto e accettato la versione pubblicata del manoscritto.
Finanziamento
Questa ricerca non ha ricevuto finanziamenti esterni.
Dichiarazione del Comitato di revisione istituzionale
Non applicabile.
Dichiarazione di consenso informato
Non applicabile.
Dichiarazione di disponibilità dei dati
Nessun nuovo dato è stato creato o analizzato in questo studio. La condivisione dei dati non è applicabile a questo articolo.
Conflitti di interesse
Gli autori non dichiarano alcun conflitto di interessi.
Referenze
- CHI. Piano d’azione globale sull’alcol 2022-2030 per rafforzare l’attuazione della strategia globale per ridurre l’uso dannoso di alcol – prima bozza. Disponibile online: https://www.who.int/publications/m/item/global-action-plan-on-alcohol-1st-draft (consultato il 18 novembre 2022).
- Giacosa, A.; Barale, R.; Bavaresco, L.; Faliva, M.A.; Gerbi, V.; La Vecchia, C.; , E.; Opizzi, A.; Perna, S.; Pezzotti, M.; et al. Modo mediterraneo di bere e longevità. Rev. Food Sci. Nutr. 2016, 56, 635–640. [Google Scholar] [CrossRef] [PubMed]
- Egger, M.; Dickersin, K.; Smith, G.D. Problemi e limitazioni nella conduzione di revisioni sistematiche. nelle revisioni sistematiche nell’assistenza sanitaria; BMJ Publishing Group: Londra, Regno Unito, 2008; pp. 43-68. [Google Scholar]
- Castellarin, S.D.; Bavaresco, L.; Falginella, L.; Van Zeller Gonçalves, M.I.; Di Gaspero, G. Fenoli nella bacca d’uva e antiossidanti chiave. In La biochimica della bacca d’uva; Gerós, H., Chavez, M.M., Delrot, S., Eds.; Bentham e Libri; Bentham Science: Sharjah, Emirati Arabi Uniti, 2012; 89-110. [Google Scholar]
- Gómez-Plaza, E.; Gil-Muñoz, R. Biochimica del vino e della birra. Biomolecole 2021, 11, 59. [Google Scholar] [CrossRef] [PubMed]
- Lucini, L.; Baccolo, G.; Rouphael, Y.; Colla, G.; Bavaresco, L.; Trevisan, M. Il trattamento con Chitosano ha suscitato meccanismi di difesa, triterpenoidi pentaciclici e accumulo di stilbeni nei grappoli d’uva (Vitis vinifera L.). Fitochimica 2018, 156, 1-8. [Google Scholar] [CrossRef] [PubMed]
- Alonso, R.; Berli, F.J.; Fontana, A.; Piccoli, P.; Bottini, Il ruolo dell’acido abscissico R. nella modulazione dei composti che contribuiscono alla qualità del vino. Piante 2021, 10, 938. [Google Scholar] [CrossRef]
- Campayo, A.; Serrano de la Hoz, K.; García-Martínez, M.M.; Salinas, M.R.; Alonso, G.L. Spruzzare acqua ozonizzata su viti Bobal: effetto sulla qualità del vino. Biomolecole 2020, 10, 213. [Google Scholar] [CrossRef]
- Paladines-Quezada, D.F.; Moreno-Olivares, J.D.; Fernández-Fernández, J.I.; Bleda-Sánchez, J.A.; Martínez-Moreno, A.; Gil-Muñoz, R. Elicitori e macerazione a freddo prefermentativa: effetti sulla concentrazione di polifenoli nelle uve e nei vini Monastrell. Biomolecole 2019, 9, 671. [Google Scholar] [CrossRef]
- Erte, E.; Vural, N.; Mehmetoğlu, Ü.; Güvenç, A. Ottimizzazione delle condizioni di trattamento di un elicitore abiotico (ultrasuoni) sulla produzione di trans-resveratrolo da Kalecik Karası. J. Alimentazione Sci. 2021, 58, 2121–2132. [Google Scholar] [CrossRef]
- Bavaresco, L.; Mattivi, F.; De Rosso, M.; Flamini, R. Effetti di elicitori, fattori viticoli e pratiche enologiche sul resveratrolo e sugli stilbeni nella vite e nel vino. Mini Rev. Med. 2012, 12, 1366–1381. [Google Scholar] [CrossRef]
- Lubin, B.R.; Inbar, N.; Pinkus, A.; Stanevsky, M.; Cohen, J.; Rahimi, O.; Anker, Y.; Shoseyov, O.; Drori, E. Le condizioni ecogeografiche influenzano drammaticamente i livelli di trans-resveratrolo e altri fenoli importanti nel vino in un’area semi-arida. Piante 2022, 11, 629. [Google Scholar] [CrossRef]
- Gatto, P.; Vrhovsek, U.; Muth, J.; Segala, C.; Romualdi, C.; Fontana, P.; Pruefer, D.; Stefanini, M.; Moser, C.; Mattivi, F.; et al. Maturazione e controllo del genotipo accumulo di stilbeni in uve sane. J. Agric. Food Chem. 2008, 56, 11773–11785. [Google Scholar] [CrossRef]
- Keskin, N.; Kunter, B.; Çelik, H. Potenziale trans-resveratrolo clonale nelle uve mature di Vitis vinifera L. cv. «Kalecik Karasi». Erwerbs-Obstbau 2020, 62, 581-585. [Google Scholar] [CrossRef]
- Gutiérrez-Gamboa, G.; Pszczòlkowski, P.; Cañon, P.; Taquichiri, M.; Peñarrieta, J.M. UV-B ratiation as a factor that deserve further research in Bolivian viticulture: A review. S. Afr. J. Enol. Vitico. 2021, 42, 201–212. [Google Scholar] [CrossRef]
- Martins, V.; Billet, K.; Garcia, A.; Lanoue, A.; Gerós, H. Il calcio esogeno devia il metabolismo delle bacche d’uva verso la produzione di più stilbenoidi e meno antociani. Chimica alimentare. 2020, 313, 126123. [Google Scholar] [CrossRef]
- Moreno, D.; Alarcón, M.V.; Uriarte, D.; Mancha, L.A.; Valdés, M.E. Irrigazione della vite attraverso due densità di germogli in composti flavonoidi e non flavonoidi in uve «Tempranillo». Piante 2022, 11, 1378. [Google Scholar] [CrossRef] [PubMed]
- Vrhovsek, U.; Wendelin, S.; Eder, R. Effetti di varie tecniche di vinificazione sulla concentrazione di isomeri glucosidi cis-e trans-resveratrolo e resveratrolo nel vino. Am. J. Enol. Vitico. 1997, 48, 214–219. [Google Scholar] [CrossRef]
- Rompkovksi, C.; Agustini, B.C.; Deffert, F.; Stadtlober, M.G.A.; Marca, D.; da Silva, G.A.; Bonfim, T.M.B. Dinamica microbica nell’impiego di fermentazione del vino su scala industriale. J. Alimentazione Sci. 2022, 59, 1570–1576. [Google Scholar] [CrossRef]
- Pezet, R.; Cuenat, P. Resveratrolo nel vino: Estrazione dalla buccia durante la fermentazione e post-fermentazione in piedi del mosto dalle uve Gamay. Am. J. Enol. Vitico. 2006, 47, 287–290. [Google Scholar]
- Gambuti, A.; Strollo, D.; Ugliano, M.; Lecce, L.; Moio, L. trans-resveratrolo, quercetina, (+)-catechina e (-)-epicatechina nei vini monovarietali del sud Italia: Relazione con il tempo di macerazione e la pressatura delle vinacce durante la vinificazione. J. Agric. Food Chem. 2004, 52, 5747–5751. [Google Scholar] [CrossRef]
- Threlfall, R.T.; Morris, J.R.; Mauromoustakos, A. Effetto della varietà, esposizione alla luce ultravioletta e metodi enologici sul livello di trans-resveratrolo del vino. Am. J. Enol. Vitico. 1999, 50, 57–64. [Google Scholar] [CrossRef]
- Jeandet, P.; Bessis, R.; Sbaghi, M.; Meunier, P.; Trollat, P. Contenuto di resveratrolo di vini di diverse età: Relazione con la pressione della malattia fungina nel vigneto. Am. J. Enol. Vitico. 1995, 46, 1–4. [Google Scholar]
- Roldán, A.; Palacios, V.; Caro, I.; Pérez, L. Evoluzione del contenuto di resveratrolo e piceidi durante il processo di vinificazione industriale del vino sherry. J. Agric. Food Chem. 2010, 58, 4268–4273. [Google Scholar] [CrossRef] [PubMed]
- Naiker, M.; Anderson, S.; Johnson, J.B.; Mani, J.S.; Eakening, L.; Bowry, V. Perdita di trans-resveratrolo durante la conservazione e l’invecchiamento dei vini rossi. Aust. J. Vino d’uva Res. 2020, 26, 385–387. [Google Scholar] [CrossRef]
- Canti, E.; Espín, J.C.; Fernández, M.J.; Oliva, J.; Tomás-Barberán, F.A. Uve irradiate con raggi UV-C post-vendemmia come potenziale fonte per la produzione di vini rossi arricchiti con stilbeni. J. Agric. Food Chem. 2003, 51, 1208–1214. [Google Scholar] [CrossRef] [PubMed]
- Kilmartin, P.A.; Oberholster, A. Vendemmia ed effetti sulla composizione del vino. In Gestione della qualità del vino, 2ª ed.; Elsevier: Amsterdam, Paesi Bassi, 2022; 705-726. [Google Scholar]
- Mansour, G.; Ghanem, C.; Mercenaro, L.; Nassif, N.; Hassoun, G.; Del Caro, A. Effetti dell’altitudine sulla composizione chimica dell’uva e del vino: una recensione. OENO One 2022, 56, 227–239. [Google Scholar] [CrossRef]
- Reynolds, A.G. Pratiche viticole e di gestione del vigneto e loro effetti sulla qualità dell’uva e del vino. In Gestione della qualità del vino, 2ª ed.; Elsevier: Amsterdam, Paesi Bassi, 2022; pp. 443-539. [Google Scholar]
- Tessitore, S.R.; Rendeiro, C.; McGettrick, H.M.; Philp, A.; Lucas, S.J.E. Vino pregiato o uva acida? Una revisione sistematica e una meta-analisi dell’impatto dei polifenoli del vino rosso sulla salute vascolare. J. Nutr. 2021, 60, 1–28. [Google Scholar] [CrossRef]
- Visioli, F.; Panaite, S.A.; Tomé-Carneiro, J. Wine’s Phenolic Compounds and Health: A Pythagorean View. Molecole 2020, 25, 4105. [Google Scholar] [CrossRef]
- Santos-Buelga, C.; González-Manzano, S.; González-Paramás, A.M. Polifenoli del vino bianco e salute. nella tecnologia del vino bianco; Elsevier: Amsterdam, Paesi Bassi, 2022. [Google Scholar]
- Albu, C.; Radu, L.E.; Radu, G.L. Valutazione del contenuto di melatonina e dei suoi precursori mediante un metodo HPLC-MS/MS da diversi vini rumeni. ACS Omega 2020, 5, 27254–27260. [Google Scholar] [CrossRef]
- Viegas, O.; Esteves, C.; Rocha, J.; Melo, A.; Ferreira, I.M.P.L. Determinazione simultanea di melatonina e trans-resveratrolo nel vino mediante microestrazione liquido-liquido dispersiva seguita da HPLC-FLD. Chimica alimentare. 2021, 339, 128091. [Google Scholar] [CrossRef]
- Mercolini, L.; Saracino, M.A.; Bugamelli, F.; Ferranti, A.; Malaguti, M.; Hrelia, S.; Raggi, M.A. HPLC-F analisi degli isomeri della melatonina e resveratroll nel vino utilizzando una procedura SPE. J. Sep. Sci. 2008, 31, 1007–1014. [Google Scholar] [CrossRef]
- Minzer, S.; Estruch, R.; Casas, R. Assunzione di vino nel quadro di una dieta mediterranea e malattie croniche non trasmissibili: una breve revisione della letteratura degli ultimi 5 anni. Molecole 2020, 25, 5045. [Google Scholar] [CrossRef]
- Forman, H.J.; Davies, K.J.; Ursini, F. Come funzionano davvero gli antiossidanti nutrizionali: tono nucleofilo e para-ormesi contro scavenging dei radicali liberi in vivo. Free Radic. Biol. Med. 2014, 66, 24–35. [Google Scholar] [CrossRef] [PubMed]
- González-Domínguez, R.; Jáuregui, O.; Mena, P.; Hanhineva, K.; Tinahones, F.J.; Angelino, D.; Andrés-Lacueva, C. Quantificare la dieta umana nella diafonia tra nutrizione e salute mediante metabolomica multi-mirata di metaboliti derivati da alimenti e microbiota. Int. J. Obes. 2020, 44, 2372–2381. [Google Scholar] [CrossRef] [PubMed]
- Gorelik, S.; Ligumsky, M.; Kohen, R.; Kanner, J. Lo stomaco come “bioreattore”: quando la carne rossa incontra il vino rosso. J. Agric. Food Chem. 2008, 56, 5002-5007. [Google Scholar] [CrossRef] [PubMed]
- Timmers, P.R.H.J.; Wilson, J.F.; Joshi, P.K.; Deelen, J. La scansione genomica multivariata implica nuovi loci e metabolismo eme nell’invecchiamento umano. Nat. Commun. 2020, 11, 3570. [Google Scholar] [CrossRef]
- Zhou, J.; Zheng, Q.; Chen, Z. Il percorso Nrf2 nelle malattie del fegato. Fronte. Cell Dev. Biol. 2022, 10, 826204. [Google Scholar] [CrossRef]
- Malaguti, M.; Angeloni, C.; Hrelia, S. I composti bioattivi nutraceutici promuovono la salute contrastando le malattie cardiovascolari. J. Am. Coll. Nutr. 2015, 34 (Suppl. S1), 22–27. [Google Scholar] [CrossRef]
- Hrelia, P.; Sita, G.; Ziche, M.; Ristori, E.; Marino, A.; Cordaro, M.; Molteni, R.; Spero, V.; Malaguti, M.; Morroni, F.; et al. Strategie protettive comuni nelle malattie neurodegenerative: concentrarsi sui fattori di rischio per colpire il sistema redox cellulare. Oxid. Med. Cell Longev. 2020, 2020, 8363245. [Google Scholar] [CrossRef]
- Xu, J.; Yang, Y.; Liu, Y.; Cao, S. Attivatori naturali Nrf2 da succhi, vini, caffè e cacao. Bevande 2020, 6, 68. [Google Scholar] [CrossRef]
- Smith, R.E.; Tran, K.; Smith, C.C.; McDonald, M.; Shejwalkar, P.; Hara, K. Il ruolo del sistema antiossidante Nrf2/ARE nella prevenzione delle malattie cardiovascolari. Malattie 2016, 4, 34. [Google Scholar] [CrossRef]
- Haunschild, R.; Marx, W. Sugli effetti sulla salute del resveratrolo nel vino. Int. J. Environ. Res. Sanità pubblica 2022, 19, 3110. [Google Scholar] [CrossRef]
- Harikumar, K.B.; Aggarwal, B.B. Resveratrolo: Un agente multibersaglio per le malattie croniche associate all’età. Ciclo cellulare 2008, 7, 1020-1035. [Google Scholar] [CrossRef]
- Meng, X.; Zhou, J.; Zhao, C.N.; Gan, R.Y.; Li, HB benefici per la salute e meccanismi molecolari del resveratrolo: una revisione narrativa. Alimenti 2020, 9, 340. [Google Scholar] [CrossRef]
- Vang, O.; Ahmad, N.; Baile, C.A.; Baur, J.A.; Marrone, K.; Csiszar, A.; Das, D.K.; Delmas, D.; Gottfried, C.; Lin, H.Y.; et al. Cosa c’è di nuovo per una vecchia molecola? Revisione sistematica e raccomandazioni sull’uso del resveratrolo. PLoS ONE 2011, 6, e19881. [Google Scholar] [CrossRef]
- Athar, M.; Indietro, J.H.; Kopelovich, L.; Bickers, D.R.; Kim, A.L. Bersagli molecolari multipli del resveratrolo: meccanismi anti-cancerogeni. Biochem. Biophys. 2009, 486, 95–102. [Google Scholar] [CrossRef]
- Beaumont, P.; Courtois, A.; Atgié, C.; Riccardo, T.; Krisa, S. All’ombra del resveratrolo: attività biologiche di epsilon-viniferina. J. Physiol. Biochem. 2022, 78, 465–484. [Google Scholar] [CrossRef]
- Guerrero, R.F.; Valls-Fonayet, J.; Riccardo, T.; Cantos-Villara, E. Una rapida quantificazione del contenuto di stilbeni nel vino mediante cromatografia liquida ad altissima pressione: spettrometria di massa. Controllo alimentare 2020, 108, 106821. [Google Scholar] [CrossRef]
- Lee, J.H.; Kim, Y.G.; Ryu, S.Y.; Cho, M.H.; Lee, J. Gli oligomeri del resveratrolo inibiscono la formazione del biofilm di Escherichia coli O157: H7 e Pseudomonas aeruginosa. J. Nat. 2014, 77, 168–172. [Google Scholar] [CrossRef]
- Vitaglione, P.; Sforza, S.; Galaverna, G.; Ghidini, C.; Caporaso, N.; Vescovi, P.P.; Fogliano, V.; Marchelli, R. Biodisponibilità del trans-resveratrolo dal vino rosso negli esseri umani. Nutr. Food Res. 2005, 49, 495–504. [Google Scholar] [CrossRef]
- Walle, T.; Hsieh, F.; DeLegge, M.H.; Oatis, J.E.; Walle, Regno Unito Alto assorbimento ma biodisponibilità molto bassa del resveratrolo orale negli esseri umani. Droga. Metab. Smaltire. 2004, 32, 1377–1382. [Google Scholar] [CrossRef]
- Goldberg, D.M.; Yan, J.; Soleas, G.J. Assorbimento di tre polifenoli legati al vino in tre diverse matrici da parte di soggetti sani. Clin. Biochimica. 2003, 36, 79–87. [Google Scholar] [CrossRef]
- Cappetta, D.; Esposito, G.; Piegari, E.; Russo, R.; Ciuffreda, L.P.; Rivellino, A.; Berrino, L.; Rossi, F.; De Angelis, A.; Urbanek, K. L’attivazione di SIRT1 attenua la disfunzione diastolica riducendo la fibrosi cardiaca in un modello di cardiomiopatia da antracicline. Int. J. Cardiol. 2016, 205, 99–110. [Google Scholar] [CrossRef]
- Liu, Z.H.; Zhang, Y.; Wang, X.; Fan, X.F.; Li, X.; Gong, Y.S.; L’attivazione di Han, L.P. SIRT1 attenua la fibrosi cardiaca mediante transizione endoteliale-mesenchimale. Biomed. Farmacoterapia. 2019, 118, 109227. [Google Scholar] [CrossRef]
- Quideau, S.; Deffieux, D.; Douat-Casassus, C.; Pouységu, L. Polifenoli vegetali: proprietà chimiche, attività biologiche e sintesi. Angew. Chem. Int. Ed. Engl. 2011, 50, 586–621. [Google Scholar] [CrossRef]
- Ji, S.B.; Parco, S.Y.; Bae, S.; Seo, H.J.; Kim, S.E.; Lee, G.M.; Wu, Z.; Liu, K.H. Indagine completa del potenziale di interazione stereoselettiva tra farmaci alimentari del resveratrolo su nove isoforme P450 e sei UGT nei microsomi epatici umani. Farmaceutica 2021, 13, 1419. [Google Scholar] [CrossRef]
- Parodi-Rullán, R.M.; Chapa-Dubocq, X.R.; Javadov, S. Acetilazione delle proteine mitocondriali nel cuore: il ruolo di SIRT3. Anteriore. Physiol. 2018, 9, 1094. [Google Scholar] [CrossRef]
- Kampoli, A.M.; Tousoulis, D.; Papageorgiou, N.; Antoniadi, C.; Androulakis, E.; Tsiamis, E.; Latsios, G.; Stefanadis, C. Metalloproteinasi della matrice nelle sindromi coronariche acute: prospettive attuali. Curr. In alto. Chem. 2012, 12, 1192–1205. [Google Scholar] [CrossRef]
- Li, H.; Xia, N.; Förstermann, U. Effetti cardiovascolari e bersagli molecolari del resveratrolo. Ossido nitrico 2012, 26, 102-110. [Google Scholar] [CrossRef]
- Ceni, E.; Mello, T.; Galli, A. Patogenesi della malattia epatica alcolica: ruolo del metabolismo ossidativo. Mondo J. Gastroenterol. 2014, 20, 17756–17772. [Google Scholar] [CrossRef] [PubMed]
- Lind, P.A.; Eriksson, C.J.; Wilhelmsen, K.C. Il ruolo dei polimorfismi dell’aldeide deidrogenasi-1 (ALDH1A1) nel consumo nocivo di alcol in una popolazione finlandese. Hum. Genom. 2008, 3, 24–35. [Google Scholar] [CrossRef]
- Vasiliou, V.; Nebert, D.W. Analisi e aggiornamento della famiglia di geni dell’aldeide deidrogenasi umana (ALDH). Hum. Genom. 2005, 2, 138–143. [Google Scholar] [CrossRef]
- Liu, Y.; Myojin, T.; Li, K.; Kurita, A.; Seto, M.; Motoyama, A.; Liu, X.; Satoh, A.; Munemasa, S.; Murata, Y.; et al. Un importante catabolita intestinale dei glicosidi quercetinici, l’acido 3-idrossifenilacetico, protegge gli epatociti dalla citotossicità indotta dall’acetaldeide attraverso il potenziamento dell’attività totale dell’aldeide deidrogenasi. Int. J. Mol. Sci. 2022, 23, 1762. [Google Scholar] [CrossRef] [PubMed]
- Moskaug, J.; Carlsen, H.; Myhrstad, M.C.; Blomhoff, R. Regolazione della sintesi di polifenoli e glutatione. Am. J. Clin. Nutr. 2005, 81, 277S–283S. [Google Scholar] [CrossRef] [PubMed]
- Matsufuji, Y.; Yamamoto, K.; Yamauchi, K.; Mitsunaga, T.; Hayakawa, T.; Nakagawa, T. Nuovi ruoli fisiologici per il glutatione nel sequestrare l’acetaldeide per conferire tolleranza all’acetaldeide in Saccharomyces cerevisiae. Microbiolo. Biotecnologie. 2013, 97, 297–303. [Google Scholar] [CrossRef] [PubMed]
- Kay, C.D.; Holub, B.J. Gli effetti postprandiali degli antiossidanti alimentari negli esseri umani. Curr. Aterosicchiere. 2003, 5, 452–458. [Google Scholar] [CrossRef]
- Ceriello, A.; Taboga, C.; Tonutti, L.; Quagliaro, L.; Piconi, L.; Bais, B.; Da Ros, R.; Motz, E. Evidenza di un effetto indipendente e cumulativo dell’ipertrigliceridemia postprandiale e dell’iperglicemia sulla disfunzione endoteliale e sulla generazione di stress ossidativo: effetti del trattamento con simvastatina a breve e lungo termine. Circolazione 2002, 106, 1211-1218. [Google Scholar] [CrossRef]
- Markoski, M.M.; Garavaglia, J.; Oliveira, A.; Olivaes, J.; Marcadenti, A. Proprietà molecolari dei composti del vino rosso e benefici cardiometabolici. Nutr. Metab. Approfondimenti 2016, 9, 51–57. [Google Scholar] [CrossRef]
- Lassaletta, A.D.; Chu, L.M.; Elmadhun, N.Y.; Burgess, T.A.; Feng, J.; Robich, M.P.; Sellke, F.W. Effetti cardioprotettivi del vino rosso e della vodka in un modello di disfunzione endoteliale. J. Surg. 2012, 178, 586–592. [Google Scholar] [CrossRef]
- Garrido-Urbani, S.; Meguenani, M.; Montecucco, F.; Imhof, B.A. Aspetti immunologici dell’aterosclerosi. Semin. Immunopathol. 2014, 36, 73–91. [Google Scholar] [CrossRef]
- Dröge, W. Radicali liberi nel controllo fisiologico della funzione cellulare. Physiol. Rev. 2002, 82, 47–95. [Google Scholar] [CrossRef]
- Di Renzo, L.; Di Pierro, D.; Bigioni, M.; Sodi, V.; Galvano, F.; Cianci, R.; La Fauci, L.; De Lorenzo, A. Lo stato plasmatico antiossidante nell’uomo è una conseguenza dell’influenza del contenuto alimentare antiossidante? Eur. Rev. Med. Pharmacol. Sci. 2007, 11, 185–192. [Google Scholar]
- Rodrigo, R.; Bosco, C.; Herrera, P.; Rivera, G. Miglioramento del danno renale mioglobinurico nei ratti da esposizione cronica al vino rosso ricco di flavonoli. Nefrolo. Trapianto di quadrante. 2004, 19, 2237–2244. [Google Scholar] [CrossRef] [PubMed]
- Ohashi, M.; Runge, M.S.; Faraci, F.M.; Heistad, D.D. Il deficit di MnSOD aumenta la disfunzione endoteliale nei topi con deficit di ApoE. Arterioscler. Trombo. Vasc. Biol. 2006, 26, 2331–2336. [Google Scholar] [CrossRef]
- Di Renzo, L.; Cioccoloni, G.; Sinibaldi Salimei, P.; Ceravolo, I.; De Lorenzo, A.; Gratteri, S. Bevande alcoliche e scelte alimentari per la prevenzione delle malattie non trasmissibili: uno studio nutrigenomico randomizzato. Oxid. Med. Longev. 2018, 2018, 5461436. [Google Scholar] [CrossRef] [PubMed]
- Ballinger, S.W.; Patterson, C.; Cavaliere-Lozano, C.A.; Burow, D.L.; Conklin, C.A.; Hu, Z.; Reuf, J.; Horaist, C.; Lebovitz, R.; Cacciatore, G.C.; et al. Integrità e funzione mitocondriale nell’aterogenesi. Circulation 2002, 106, 544–549. [Google Scholar] [CrossRef]
- Kasdallah-Grissa, A.; Mornagui, B.; Aouani, E.; Hammami, M.; El May, M.; Gharbi, N.; Kamoun, A.; El-Fazaâ, S. Il resveratrolo, un polifenolo del vino rosso, attenua lo stress ossidativo indotto dall’etanolo nel fegato di ratto. Vita Sci. 2007, 80, 1033–1039. [Google Scholar] [CrossRef] [PubMed]
- Werner, T. Analisi dei cluster e modellazione del promotore come strumenti bioinformatici per l’identificazione di geni bersaglio da dati di array di espressione. Farmacogenomica 2001, 2, 25-36. [Google Scholar] [CrossRef]
- Yamamoto, H.; Schoonjans, K.; Auwerx, J. Funzioni di sirtuina in salute e malattia. Mol. Endocrinolo. 2007, 21, 1745–1755. [Google Scholar] [CrossRef]
- Wang, F.; Nguyen, M.; Qin, F.X.; Tong, Q. SIRT2 deacetila FOXO3a in risposta allo stress ossidativo e alla restrizione calorica. Aging Cell 2007, 6, 505-514. [Google Scholar] [CrossRef]
- Di Renzo, L.; Carraro, A.; Valente, R.; Iacopino, L.; Colica, C.; De Lorenzo, A. L’assunzione di vino rosso in diversi pasti modula il livello di LDL ossidato, l’espressione genica ossidativa e infiammatoria in persone sane: uno studio crossover randomizzato. Oxid. Med. Longev. 2014, 2014, 681318. [Google Scholar] [CrossRef]
- Kim, M.J.; Kim, D.W.; Parco, J.H.; Kim, S.J.; Lee, C.H.; Yong, J.I.; Ryu, E.J.; Cho, S.B.; Yeo, H.J.; Hyeon, J.; PEP-1-SIRT2 inibisce la risposta infiammatoria e la morte cellulare indotta dallo stress ossidativo attraverso l’espressione di enzimi antiossidanti nei macrofagi murini. Free Radic. Biol. Med. 2013, 63, 432–445. [Google Scholar] [CrossRef]
- Zheng, Y.; Le, V.; Cheng, Z.; Xie, S.; Li, H.; Tian, J.; Liu, J. Sviluppo di un sistema di segnalazione della luciferasi guidato dal promotore HSPA1A rapido e altamente sensibile per la valutazione dello stress ossidativo associato alla terapia fotodinamica a basso dosaggio. Cell Stress Chaperones 2013, 18, 203-213. [Google Scholar] [CrossRef] [PubMed]
- Kulkarni, S.S.; Cantó, C. I bersagli molecolari del resveratrolo. Biochim. Biophys. Acta 2015, 1852, 1114–1123. [Google Scholar] [CrossRef] [PubMed]
- Mukamal, K.J.; Conigrave, K.M.; Mittleman, M.A.; Camargo, C.A.; Stampfer, M.J.; Willett, W.C.; Rimm, E.B. Ruoli del modello di consumo e del tipo di alcol consumato nella malattia coronarica negli uomini. N. Engl. J. Med. 2003, 348, 109–118. [Google Scholar] [CrossRef] [PubMed]
- Waterhouse, A.L. Fenoli del vino. Ann. N. Y. Acad. Sci. 2002, 957, 21–36. [Google Scholar] [CrossRef]
- Cordova, A.C.; Sumpio, B.E. I polifenoli sono una medicina: è tempo di prescrivere vino rosso per i nostri pazienti? Int. J. Angiol. 2009, 18, 111–117. [Google Scholar] [CrossRef]
- Rimm, E.B.; Giovannucci, E.L.; Willett, W.C.; Colditz, G.A.; Ascherio, A.; Rosner, B.; Stampfer, MJ Studio prospettico del consumo di alcol e del rischio di malattia coronarica negli uomini. Lancet 1991, 338, 464-468. [Google Scholar] [CrossRef]
- Yano, K.; Rhoads, G.G.; Kagan, A. Caffè, alcol e rischio di malattia coronarica tra gli uomini giapponesi che vivono alle Hawaii. N. Engl. J. Med. 1977, 297, 405–409. [Google Scholar] [CrossRef]
- Corrao, G.; Rubbiati, L.; Bagnardi, V.; Zambon, A.; Poikolainen, K. Alcol e malattia coronarica: una meta-analisi. Dipendenza 2000, 95, 1505-1523. [Google Scholar] [CrossRef]
- Grønbaek, M.; Deis, A.; Sørensen, T.I.; Becker, U.; Schnohr, P.; Jensen, G. Mortalità associata a moderata assunzione di vino, birra o alcolici. BMJ 1995, 310, 1165–1169. [Google Scholar] [CrossRef]
- Stampfer, M.J.; Colditz, G.A.; Willett, W.C.; Speizer, F.E.; Hennekens, C.H. Uno studio prospettico sul consumo moderato di alcol e sul rischio di malattia coronarica e ictus nelle donne. N. Engl. J. Med. 1988, 319, 267–273. [Google Scholar] [CrossRef]
- Keil, U.; Chambless, L.E.; Döring, A.; Filipiak, B.; Stieber, J. La relazione tra l’assunzione di alcol e la malattia coronarica e la mortalità per tutte le cause in una popolazione che beve birra. Epidemiologia 1997, 8, 150-156. [Google Scholar] [CrossRef] [PubMed]
- Grønbaek, M.; Becker, U.; Johansen, D.; Gottschau, A.; Schnohr, P.; Hein, H.O.; Jensen, G.; Sørensen, T.I. Tipo di alcol consumato e mortalità per tutte le cause, malattia coronarica e cancro. Ann. Intern. Med. 2000, 133, 411–419. [Google Scholar] [CrossRef] [PubMed]
- Levantesi, G.; Marfisi, R.; Mozaffariano, D.; Franzosi, M.G.; Maggioni, A.; Nicolosi, G.L.; Schweiger, C.; Silletta, M.; Tavazzi, L.; Tognoni, G.; et al. Consumo di vino e rischio di eventi cardiovascolari dopo infarto miocardico: risultati dello studio GISSI-Prevenzione. Int. J. Cardiol. 2013, 163, 282–287. [Google Scholar] [CrossRef] [PubMed]
- Renaud, S.; de Lorgeril, M. Vino, alcol, piastrine e il paradosso francese per la malattia coronarica. Lancet 1992, 339, 1523–1526. [Google Scholar] [CrossRef] [PubMed]
- Torres, A.; Cachofeiro, V.; Millán, J.; Lahera, V.; Nieto, M.; Martin, R.; Bello, E.; Alvarez-Sala, L.; Nieto, M. L’assunzione di vino rosso ma non di altre bevande alcoliche aumenta la capacità antiossidante totale e migliora il profilo pro-infiammatorio dopo una dieta ricca di grassi orali in volontari sani. Revista Clínica Española 2015, 215, 486–494. [Google Scholar] [CrossRef]
- Gea, A.; Bes-Rastrollo, M.; Toledo, E.; Garcia-Lopez, M.; Beunza, J.J.; Estruch, R.; Martinez-Gonzalez, M.A. Modello mediterraneo di consumo di alcol e mortalità nel progetto SUN (Seguimiento Universidad de Navarra): uno studio prospettico di coorte. Fr. J. Nutr. 2014, 111, 1871–1880. [Google Scholar] [CrossRef]
- Castaldo, L.; Narváez, A.; Izzo, L.; Graziani, G.; Gaspari, A.; Minno, G.D.; Ritieni, A. Consumo di vino rosso e salute cardiovascolare. Molecole 2019, 24, 3626. [Google Scholar] [CrossRef]
- Haseeb, S.; Alessandro, B.; Baranchuk, A. Vino e salute cardiovascolare: una revisione completa. Circolazione 2017, 136, 1434-1448. [Google Scholar] [CrossRef]
- Baliunas, D.O.; Taylor, B.J.; Irving, H.; Roerecke, M.; Patrasso, J.; Mohapatra, S.; Rehm, J. Alcol come fattore di rischio per il diabete di tipo 2: una revisione sistematica e meta-analisi. Diabetes Care 2009, 32, 2123-2132. [Google Scholar] [CrossRef]
- Rochitte, C.E.; Laurindo, F.R. Carico di placca coronarica e punteggi di calcio in uomini sani che aderiscono a bere vino a lungo termine o astinenza da alcol. Braz. J. Med. Biol. 2014, 47, 697–705. [Google Scholar]
- Chiva-Blanch, G.; Urpi-Sarda, M.; Ros, E.; Valderas-Martinez, P.; Casas, R.; Arranz, S.; Guillén, M.; Lamuela-Raventós, R.M.; Llorach, R.; Andres-Lacueva, C.; et al. Effetti dei polifenoli del vino rosso e dell’alcol sul metabolismo del glucosio e sul profilo lipidico: uno studio clinico randomizzato. Clin. Nutr. 2013, 32, 200–206. [Google Scholar] [CrossRef] [PubMed]
- Qureshi, S.A.; Lund, A.C.; Veierød, M.B.; Carlsen, M.H.; Blomhoff, R.; Andersen, L.F.; Ursina, G. Prodotti alimentari che contribuiscono maggiormente alla variazione dell’assunzione di antiossidanti; uno studio trasversale tra le donne norvegesi. BMC Sanità pubblica 2014, 14, 45. [Google Scholar] [CrossRef] [PubMed]
- Blomster, J.I.; Zoungas, S.; Chalmers, J.; Li, Q.; Chow, C.K.; Woodward, M.; Mancia, G.; Poulter, N.; Williams, B.; Harrap, S.; et al. La relazione tra consumo di alcol e complicanze vascolari e mortalità in individui con diabete di tipo 2. Cura del diabete 2014, 37, 1353-1359. [Google Scholar] [CrossRef] [PubMed]
- Gepner, Y.; Golan, R.; Harman-Boehm, I.; Henkin, Y.; Schwarzfuchs, D.; Shelef, I.; Durst, R.; Kovsan, J.; Bolotin, A.; Leitersdorf, E.; et al. Effetti dell’inizio dell’assunzione moderata di alcol sul rischio cardiometabolico negli adulti con diabete di tipo 2: uno studio randomizzato e controllato di 2 anni. Ann. Stagista Med. 2015, 163, 569–579. [Google Scholar] [CrossRef]
- Gupta, S.; Warner, J. Demenza correlata all’alcol: un’epidemia silenziosa del 21 ° secolo? Br. J. Psichiatria 2008, 193, 351-353. [Google Scholar] [CrossRef]
- Letenneur, L. Rischio di demenza e consumo di alcol e vino: una revisione dei risultati recenti. Biol. Res. 2004, 37, 189–193. [Google Scholar] [CrossRef]
- Lucerón-Lucas-Torres, M.; Cavero-Redondo, I.; Martínez-Vizcaíno, V.; Saz-Lara, A.; Pascual-Morena, C.; Álvarez-Bueno, C. Associazione tra consumo di vino e declino cognitivo nelle persone anziane: una revisione sistematica e una meta-analisi degli studi longitudinali. Fronte. Nutr. 2022, 9, 863059. [Google Scholar] [CrossRef]
- Truelsen, T.; Gronbaek, M.; Schnohr, P.; Boysen, G. Assunzione di birra, vino e alcolici e rischio di ictus: lo studio sul cuore della città di Copenaghen. Ictus 1998, 29, 2467-2472. [Google Scholar] [CrossRef]
- Cerhan, J.R.; Folsom, A.R.; Mortimer, J.A.; Shahar, E.; Knopman, D.S.; McGovern, P.G.; Hays, M.A.; Crum, L.D.; Heiss, G. Correlati della funzione cognitiva negli adulti di mezza età. Investigatori dello studio sul rischio di aterosclerosi nelle comunità (ARIC). Gerontologia 1998, 44, 95-105. [Google Scholar] [CrossRef]
- Ngandu, T.; Helkala, E.L.; Soininen, H.; Winblad, B.; Tuomilehto, J.; Nissinen, A.; Kivipelto, M. Bere alcol e funzioni cognitive: risultati dello studio CAIDE (Cardiovascular Risk Factors Aging and Dementia). Demente. Geriatr. Cogn. Disord. 2007, 23, 140–149. [Google Scholar] [CrossRef]
- Espeland, M.A.; Coker, L.H.; Wallace, R.; Rapp, S.R.; Resnick, S.M.; Limacher, M.; Powell, L.H.; Messina, C.R.; Women’s Health Initiative Studio sull’invecchiamento cognitivo. Associazione tra assunzione di alcol e funzione cognitiva specifica del dominio nelle donne anziane. Neuroepidemiologia 2006, 27, 1-12. [Google Scholar] [CrossRef]
- Duffy, J.C. Consumo di alcol e mortalità per tutte le cause. Int. J. Epidemiol. 1995, 24, 100–105. [Google Scholar] [CrossRef] [PubMed]
- Pinder, R.M.; Sandler, M. Alcol, vino e salute mentale: concentrarsi su demenza e ictus. J. Psicofarmacol. 2004, 18, 449–456. [Google Scholar] [CrossRef]
- Xu, G.; Liu, X.; Yin, Q.; Zhu, W.; Zhang, R.; Fan, X. Consumo di alcol e transizione del decadimento cognitivo lieve alla demenza. Psichiatria Clin. Neurosci. 2009, 63, 43–49. [Google Scholar] [CrossRef] [PubMed]
- Collins, M.A.; Neafsey, E.J.; Mukamal, K.J.; Grigio, M.O.; Parchi, D.A.; Das, D.K.; Korthuis, R.J. Alcol con moderazione, cardioprotezione e neuroprotezione: considerazioni epidemiologiche e studi meccanicistici. Alcool. Clin. Exp. Res. 2009, 33, 206–219. [Google Scholar] [CrossRef]
- Gruppo di lavoro IARC sulla valutazione dei rischi cancerogeni per l’uomo: consumo di alcol e carbammato di etile. IARC Monogr. Eval. Carcinog. rischi Hum. 2010, 96, 3–1383.
- Il terzo rapporto di esperti: World Cancer Research Fund/American Institute for Cancer Research. Dieta, nutrizione, attività fisica e cancro: una prospettiva globale. Rapporto dell’esperto di progetto di aggiornamento continuo. Disponibile online: Dietandcancerreport.org (consultato il 20 dicembre 2022).
- Centri per il controllo e la prevenzione delle malattie (CDC) degli Stati Uniti d’America: linee guida dietetiche per l’alcol. Disponibile online: https://www.cdc.gov/alcohol/fact-sheets/moderate-drinking.htm (consultato il 20 dicembre 2022).
- Clinton, S.K.; Giovannucci, E.L.; Hursting, S.D. Il terzo rapporto di esperti del World Cancer Research Fund / American Institute for Cancer Research su dieta, nutrizione, attività fisica e cancro: impatto e direzioni future. J. Nutr. 2020, 150, 663–671. [Google Scholar] [CrossRef]
- ECL. Association of European Cancer League: il codice europeo contro il cancro. Disponibile online: https://www.cancer.eu/cancer-prevention-the-european-code-against-cancer/ (consultato il 20 dicembre 2022).
- Scoccianti, C.; Cecchini, M.; Anderson, A.S.; Berrino, F.; Boutron-Ruault, M.C.; Espina, C.; Chiave, T.J.; Leitzmann, M.; Norat, T.; Poteri, H.; Codice europeo contro il cancro 4a edizione: consumo di alcol e cancro. Cancro Epidemiol. 2016, 45, 181–188. [Google Scholar] [CrossRef]
- Bradamante, S.; Barenghi, L.; Villa, A. Effetti protettivi cardiovascolari del resveratrolo. Cardiovascolare. Droga. Rev. 2004, 22, 169–188. [Google Scholar] [CrossRef]
- Aluyen, J.K.; Ton, Q.N.; Tran, T.; Yang, A.E.; Gottlieb, H.B.; Bellanger, R.A. Resveratrolo: Potenziale come agente antitumorale. J. Dieta. Suppl. 2012, 9, 45–56. [Google Scholar] [CrossRef]
- Chao, C.; Li, Q.; Zhang, F.; Bianco, E. Consumo di alcol e rischio di cancro ai polmoni nello studio VITamins e stile di vita. Nutr. Cancro 2011, 63, 880-888. [Google Scholar] [CrossRef]
- Chao, C.; Haque, R.; Caan, B.J.; Poon, K.Y.; Tseng, H.F.; Quinn, VP Il consumo di vino rosso non è associato a un ridotto rischio di cancro del colon-retto. Nutr. Cancro 2010, 62, 849-855. [Google Scholar] [CrossRef] [PubMed]
- Sutcliffe, S.; Giovannucci, E.; Leitzmann, M.F.; Rimm, E.B.; Stampfer, M.J.; Willett, W.C.; Platz, E.A. Uno studio prospettico di coorte sul consumo di vino rosso e sul rischio di cancro alla prostata. Int. J. Cancer 2007, 120, 1529–1535. [Google Scholar] [CrossRef] [PubMed]
- Di Castelnuovo, A.; Costanzo, S.; Bonaccio, M.; McElduff, P.; Linneberg, A.; Salomaa, V.; Männistö, S.; Moitry, M.; Ferrières, J.; Dallongeville, J.; et al. Assunzione di alcol e mortalità totale in 142 960 individui del progetto MORGAM: uno studio basato sulla popolazione. Dipendenza 2022, 117, 312-325. [Google Scholar] [CrossRef] [PubMed]
- Giacosa, A.; Barale, R.; Bavaresco, L.; Gatenby, P.; Gerbi, V.; Janssens, J.; Johnston, B.; Kas, K.; La Vecchia, C.; Mainguet, P.; et al. Prevenzione del cancro in Europa: la dieta mediterranea come scelta protettiva. Eur. J. Cancro Prec. 2013, 22, 90–95. [Google Scholar] [CrossRef]
- Turati, F.; Carioli, G.; Bravi, F.; Ferraroni, M.; Serraino, D.; Montella, M.; Giacosa, A.; Toffolutti, F.; , E.; Levi, F.; et al. Dieta mediterranea e rischio di cancro al seno. Nutrienti 2018, 10, 326. [Google Scholar] [CrossRef]
- Bambola, R.; Peto, R.; Boreham, J.; Sutherland, I. Mortalità in relazione al consumo di alcol: uno studio prospettico tra i medici britannici maschi. Int. J. Epidemiol. 2005, 34, 199–204. [Google Scholar] [CrossRef]
- Jayasekara, H.; Inglese, D.R.; Camera, R.; MacInnis, R.J. Consumo di alcol nel tempo e rischio di morte: una revisione sistematica e una meta-analisi. Am. J. Epidemiol. 2014, 179, 1049–1059. [Google Scholar] [CrossRef]
- Grønbaek, M.; Johansen, D.; Becker, U.; Hein, H.O.; Schnohr, P.; Jensen, G.; Vestbo, J.; Sørensen, T.I. Cambiamenti nell’assunzione di alcol e mortalità: uno studio longitudinale basato sulla popolazione. Epidemiologia 2004, 15, 222-228. [Google Scholar] [CrossRef]
- Mazucanti, C.H.; Cabral-Costa, J.V.; Vasconcelos, A.R.; Andreotti, D.Z.; Scavone, C.; Kawamoto, E.M. Longevity Pathways (mTOR, SIRT, Insulin/IGF-1) come bersagli modulatori chiave sull’invecchiamento e la neurodegenerazione. Curr. In alto. Chem. 2015, 15, 2116–2138. [Google Scholar] [CrossRef]
- Morselli, E.; Maiuri, M.C.; Markaki, M.; Megalou, E.; Pasparaki, A.; Palikaras, K.; Criollo, A.; Galluzzi, L.; Malik, S.A.; Vitale, I.; et al. La restrizione calorica e il resveratrolo promuovono la longevità attraverso l’induzione dell’autofagia dipendente dalla Sirtuina-1. Cellula. Morte Dis. 2010, 1, e10. [Google Scholar] [CrossRef] [PubMed]
- Cena, H.; Calder, P.C. Definizione di una dieta sana: prove del ruolo dei modelli dietetici contemporanei nella salute e nella malattia. Nutrienti 2020, 12, 334. [Google Scholar] [CrossRef] [PubMed]
- Ditano-Vázquez, P.; Torres-Peña, J.D.; Galeano-Valle, F.; Pérez-Caballero, A.I.; Demelo-Rodríguez, P.; Lopez-Miranda, J.; Katsiki, N.; Delgado-Lista, J.; Alvarez-Sala-Walther, L.A. L’aspetto fluido della dieta mediterranea nella prevenzione e gestione delle malattie cardiovascolari e del diabete: il ruolo del contenuto di polifenoli nel consumo moderato di vino e olio d’oliva. Nutrienti 2019, 11, 2833. [Google Scholar] [CrossRef]
- Golan, R.; Gepner, Y.; Shai, I. Vino e salute-Nuove prove. Eur. J. Clin. Nutr. 2019, 72, 55–59. [Google Scholar] [CrossRef] [PubMed]
- Stockwell, T.; Zhao, J.; Panwar, S.; Roemer, A.; Naimi, T.; Chikritzhs, T. I bevitori “moderati” hanno ridotto il rischio di mortalità? Una revisione sistematica e una meta-analisi del consumo di alcol e della mortalità per tutte le cause. J. Stud. Alcool. Droghe 2016, 77, 185-198. [Google Scholar] [CrossRef] [PubMed]
- Bergmann, M.M.; Rehm, J.; Klipstein-Grobusch, K.; Boeing, H.; Schütze, M.; Drogan, D.; Overvad, K.; Tjønneland, A.; Halkjær, J.; Fagherazzi, G.; et al. L’associazione del modello di consumo di alcol nel corso della vita e della causa di morte nello studio EPIC (European prospective investigation into cancer and nutrition). Int. J. Epidemiol. 2013, 42, 1772–1790. [Google Scholar] [CrossRef]
- Collaboratori, G.A. Rischi a livello di popolazione del consumo di alcol per quantità, geografia, età, sesso e anno: un’analisi sistematica per il Global Burden of Disease Study 2020. Lancet 2022, 400, 185-235. [Google Scholar] [CrossRef]
- Dipartimento di errore. Lancetta 2022, 400, 358. [CrossRef]
- CHI. Alcool. Disponibile online: https://www.who.int/news-room/fact-sheets/detail/alcohol (consultato il 20 dicembre 2022).
- Deluca, P.; Coulton, S.; Alam, M.F.; Bonifacio, S.; Cohen, D.; Donoghue, K.; Gilvarry, E.; Kaner, E.; Maconochie, I.; McArdle, P.; et al. Brevi interventi per prevenire l’uso eccessivo di alcol negli adolescenti a basso rischio che si presentano ai Dipartimenti di Emergenza: Studio randomizzato a tre bracci di efficacia e costo-efficacia. Int. J. Drug Policy 2021, 93, 103113. [Google Scholar] [CrossRef]
- Ryan, S.A.; Kokotailo, P.; Comitato per l’uso e la prevenzione delle sostanze; Camenga, D.R.; Patrick, S.W.; Plumb, J.; Quigley, J.; Walker-Harding, L. Uso di alcol da parte dei giovani. Pediatria 2019, 144, e20191357. [Google Scholar] [CrossRef]
- Anderson, P. L’impatto delle bevande alcoliche sulla salute umana. Nutrienti 2021, 13, 4417. [Google Scholar] [CrossRef] [PubMed]
- Santos-Buelga, C.; González-Manzano, S.; González-Paramás, A.M. Vino, polifenoli e diete mediterranee. Cos’altro dire? Molecole 2021, 26, 5537. [Google Scholar] [CrossRef] [PubMed]
- Tamargo, A.; Cueva, C.; Silva, M.; Molinero, N.; Miralles, B.; Bartolomé, B.; Moreno-Arribas, M.V. La co-digestione gastrointestinale dei polifenoli del vino con proteine del glucosio / siero di latte influenza la loro bioaccessibilità e l’impatto sul microbiota del colon. Food Res. Int. 2022, 155, 111010. [Google Scholar] [CrossRef] [PubMed]
